常温下,某一元酸HA溶液的pH为b,且有n(A-)∶n(HA)=1∶99。某一元强碱溶液的pH为a。若将1体积的此强碱溶液与100体积的HA溶液混合,恰好完全反应。则a与b之和为
A.16 B.17 C. 18 D.15
在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液。当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
| A.1∶9 | B.1∶1 | C.1∶2 | D.1∶4 |
常温下,向0.1 mol/L的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时不同阶段的溶液,下列有关说法中不正确的是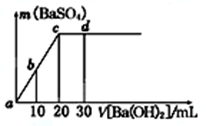
| A.溶液的pH:a<b<c<d |
| B.溶液的导电能力:a>b>d>c |
| C.c、d溶液呈碱性 |
| D.a、b溶液呈酸性 |
用0.1 mol/L NaOH溶液滴定0.1 mol/L盐酸,如达到滴定终点时不慎多加1滴NaOH溶液(1滴溶液体积约为0.05 mL),继续加水至50 mL,所得溶液的pH是
| A.4 | B.7.2 | C.10 | D.11.3 |
常温下,pH=13的强碱溶液和pH=2的强酸溶液混合,所得溶液的pH=11,则强碱溶液和强酸溶液的体积之比为
| A.11:1 | B.9:1 | C.1:11 | D.1:9 |
下列叙述正确的是( )。
| A.任何浓度的溶液都可以用pH来表示其酸性的强弱 |
| B.c(H+)=1×10-7 mol·L-1的溶液一定是中性溶液 |
| C.0.2 mol·L-1 CH3COOH溶液中的c(H+)是0.1 mol·L-1 CH3COOH溶液中的c(H+)的2倍 |
| D.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)·c(OH-)都是定值。 |
如图曲线a和b是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是 ( )

| A.盐酸的物质的量浓度为1 mol·L-1 | B.P点时恰好完全中和,溶液呈中性 |
| C.曲线a是盐酸滴定氢氧化钠溶液的滴定曲线 | D.酚酞不能用作本实验的指示剂 |
下列说法错误的( )
| A.0.1 mol·L-1的CH3COOH溶液中,由水电离的c(H+)为10-13mol·L-1 |
| B.pH=2与pH=1的CH3COOH溶液中c(H+)之比为1∶10 |
| C.等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,混合后溶液pH<7 |
| D.1 mol甲烷分子中含有共价键的个数为4NA |
有等体积、氢氧根离子浓度相等的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是( )
| A.V3>V2>V1 | B.V3=V2=V1 | C.V3>V2=V1 | D.V1=V2>V3 |
要使10ml0.05mol/L的H2SO4溶液PH变为7,应采用的方法是( )
| A.加水稀释到1000ml | B.加入10ml0.1mol/L的氨水 |
| C.加入100ml0.005mol/L的Ba(OH)2溶液 | D.加入100ml0.05mol/L的NaOH溶液 |
若1体积硫酸恰好与10体积PH=11的氢氧化钠溶液完全反应,则二者的物质的量浓度值比应为( )
| A.10:1 | B.5:1 | C.1:1 | D.1:10 |
相同条件下,①氯化钠溶液 ②醋酸钠溶液 ③碳酸钠溶液 ④碳酸氢钠溶液,它们的PH相对大小为( )
| A.④>③>②>① | B.③>④>②>① | C.②>③>④>① | D.③>②>④>① |
室温时,下列混合溶液的pH一定小于7的是( )
| A.pH=3盐酸和pH=11的氨水溶液等体积混合 |
| B.pH=3盐酸和pH=11的氢氧化钡溶液等体积混合 |
| C.pH=3醋酸和pH=11的氢氧化钡溶液等体积混合 |
| D.pH=3硫酸和pH=11的氨水溶液等体积混合 |
试题篮
()