100℃,Kw=1.0×10-12,若在此温度时,某溶液中的c(H+)=1.0×10-7 mol•L-1,则该溶液
| A.呈中性 | B.呈碱性 |
| C.呈酸性 | D.1000c(H+)=c(OH-) |
(原创)液氨与纯水类似,也存在微弱的电离:NH3+ NH3 NH4+ +NH2- ,下列说法不正确的是( )
NH4+ +NH2- ,下列说法不正确的是( )
| A.只要不加入其他物质,液氨中c(NH4+ )总是等于c(NH2-) |
| B.一定温度下, c(NH4+ )×c(NH2-)为常数 |
| C.其他条件不变,增加液氨的量,电离平衡正向移动 |
| D.维持温度不变,向液氨中加入少量NH4Cl固体,c(NH2-)将减少 |
用0.1000 mol·L-1NaOH溶液滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是( )
| A.盛装待测液的锥形瓶用蒸馏水洗过,没用待测液润洗 |
| B.酸式滴定管在使用前未用待测液盐酸润洗 |
| C.滴定前碱式滴定管尖嘴中有气泡,滴定后气泡消失 |
| D.滴定前读数平视,滴定终点读数时俯视碱式滴定管的刻度 |
常温下,向纯水中加入NaOH使溶液的pH为11,则由NaOH电离出的OH 离子浓度和水电离出的OH离子浓度之比为 ( )
| A.1:1 | B.108:1 | C.5×109:1 | D.1010:1 |
(原创)如图表示不同温度下水溶液中c(H+)与c(OH-)的关系,下列判断正确的是( )
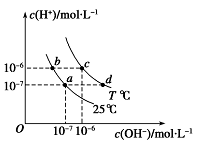
| A.两条曲线上任意点均有c (H+) ×c (OH-)=Kw |
| B.T<25℃ |
| C.b点和c点pH均为6,溶液呈酸性 |
| D.只采用升温的方式,可由a点变成d点 |
有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是( )
| A.V3=V2=V1 | B.V3>V2=V1 | C.V1=V2>V3 | D.V3>V2>V1 |
下列与滴定实验有关的说法中正确的是
| A.用NaOH滴定盐酸时,只能用酚酞作指示剂 |
| B.用KMnO4滴定亚硫酸钠溶液的实验中不需要另外加入指示剂 |
| C.用滴定管准确量取20.0 mL盐酸 |
| D.用NaOH滴定盐酸时,若滴定结束时俯视刻度,会导致测定结果偏高 |
水的电离过程为H2O H++OH—,在不同温度下其平衡常数为Kw (25℃)=1.0×10-14,Kw (35℃)=2.1×10-14。则下列叙述正确的是
H++OH—,在不同温度下其平衡常数为Kw (25℃)=1.0×10-14,Kw (35℃)=2.1×10-14。则下列叙述正确的是
| A.水的电离是一个放热过程 |
| B.35℃时,c(H+)>c(OH-) |
| C.25℃时,pH=3的盐酸中由水电离产生的c(OH-)=1.0×10-3mol/L |
| D.25℃时,向溶液中加入稀氨水,平衡逆向移动,Kw不变 |
下列说法正确的是
| A.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
| B.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的2倍 |
| C.室温下,pH=3的亚硫酸溶液中的氢离子浓度与pH=11的氨水中的氢氧根离子浓度相等 |
| D.室温时,将pH=5的H2SO4溶液稀释1000倍,则c(H+):c (SO42-)=2:1 |
下列溶液均处于25℃,有关叙述正确的是
| A.将醋酸溶液加水稀释1000倍,pH增大3 |
| B.在NaHCO3溶液中,c(Na+)=c(HCO3-)+c(H2CO3) |
| C.pH=8的Ba(OH)2溶液和pH=8的氨水中,由水电离的c(OH-)均为1×10-8mo1•L-1 |
| D.pH=13的NaOH溶液与pH=1的盐酸混合后,一定有c(H+)=c(OH-) |
某温度下,相同pH值的盐酸和醋酸分别加水稀释,平衡pH值随溶液体积变化曲线如图所示,据图判断正确的是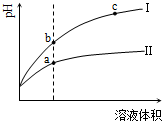
| A.Ⅱ为盐酸稀释时的pH值变化曲线 |
| B.b点溶液的导电性比c点溶液的导电性强 |
| C.a点Kw的数值比c点Kw的数值大 |
| D.b点酸的总浓度大于a点酸的总浓度 |
已知水的电离方程式:H2O H++OH-,下列叙述中,正确的是
H++OH-,下列叙述中,正确的是
| A.升高温度,KW增大,pH不变 |
| B.向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 |
| C.向水中加入少量硫酸,c(H+)增大,KW不变 |
| D.向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低 |
对pH值相同的盐酸和醋酸两种溶液的说法正确的是
| A.中和碱的能力相同 | B.盐酸和醋酸的物质的量浓度相同 |
| C.OH-的物质的量浓度相同 | D.H+的物质的量浓度不同 |
试题篮
()