常温下某溶液中由水电离产生的[H+]=1×10-5mol·L-1,则下列叙述正确的是
| A.一定是碱溶液 |
| B.一定是酸溶液 |
| C.由水电离出的[OH-]=1×10-9mol·L-1 |
| D.pH值可能为9也可能为5 |
25 ℃时,水的电离达到平衡:H2O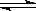 H++OH-;△H>0,下列叙述正确的是
H++OH-;△H>0,下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,KW增大,pH不变 |
下列叙述正确的是
| A.SO2是电解质,其水溶液能导电 |
| B.酸式盐的水溶液一定呈酸性 |
| C.常温时水电离出的c(H+)=10-4 mol/L的溶液,不可能是稀盐酸 |
| D.常温时纯水的电离平衡常数为1.0×10-14 |
下列溶液一定呈中性的是
A.溶液中 (KW为溶液所处温度时水的离子积常数) (KW为溶液所处温度时水的离子积常数) |
| B.pH=7的溶液 |
| C.使石蕊试液呈紫色的溶液 |
| D.等体积0.1 mol·L-1硫酸与0.1 mol·L-1的氢氧化钠溶液混合后的溶液 |
在25 ℃时,将pH=11的NaOH溶液a mL 与pH=1的H2SO4溶液b mL混合, 当恰好完全中和时, a 与b的比值为
| A.1000:1 | B.100:1 | C.50:1 | D.10:1 |
常温下取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
| A.0.01mol/L | B.0.017mol/L | C.0.05mol/L | D.0.50mol/L |
用0.1mol/L的NaOH溶液滴定100mL0.1mol/L盐酸时,如果滴定误差在±0.1%以内,反应完毕后,溶液的pH范围是
| A.4.3~9.7 | B.3.3~10.7 | C.6.9~7.1 | D.6~8 |
室温下,下列叙述正确的是
| A.在醋酸溶液的pH=a,将此溶液稀释1倍后溶液的pH=b,则a>b |
| B.在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 |
| C.1×10-3 mol/L盐酸的pH=3.0,1×10-8 mol·L-1盐酸的pH=8.0 |
| D.若1 mL pH=1的盐酸与100 mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 |
在某温度下,0.01 mol·L-1 NaOH溶液和0.01 mol·L-1的盐酸相比,下列说法正确的是
| A.由水电离出的c(H+)相等 |
| B.由水电离出的c(H+)都是1.0×10-12 mol·L-1 |
| C.由水电离出的c(OH-)都是0.01 mol·L-1 |
| D.两者都促进了水的电离 |
已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA溶液与b mol·L-1的一元碱BOH溶液等体积混合,可判定该溶液呈中性的依据是
| A.a=b |
| B.混合溶液的pH=7 |
| C.混合溶液中,c(H+)= mol·L-1 |
| D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-) |
25 ℃时,水的电离达到平衡:H2O  H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw增大 |
| C.降温,使平衡左移,c(H+)减小,溶液呈碱性 |
| D.将水加热,Kw增大,pH减小 |
下列有关水电离情况的说法正确的是
| A.25℃,pH=12的烧碱溶液与纯碱溶液,水的电离程度相同 |
| B.其它条件不变,稀释醋酸钠溶液,水的电离程度增大 |
| C.其它条件不变,稀释氢氧化钠溶液,水的电离程度减小 |
| D.其它条件不变,温度升高,水的电离程度增大,Kw增大 |
在室温下,等体积的酸和碱溶液混合后pH一定小于7的是
| A.pH=3的HNO3跟pH=11的KOH溶液 |
| B.pH=3的HNO3跟pH=11的氨水 |
| C.pH=3的硫酸跟pH=11的KOH溶液 |
| D.pH=3的醋酸跟pH=11的氢氧化钡溶液 |
把1mL0.1mol•L-1的硫酸加水稀释成2L溶液,在此溶液中由水电离产生的H+,接近于
| A.1.0×10-4mol/L | B.1.0×10-8mol/L |
| C.1.0×10-10mol/L | D.1.0×10-11mol/L |
试题篮
()