25℃时,用0.100 mol/L NaOH 溶液分别滴定20.00 mL 0.100 mol/L的盐酸和20.00 mL 0.100 mol/L醋酸(忽略温度变化)。下列说法正确的是
| A.滴定前,盐酸和醋酸溶液中:c(Cl‾)<c(CH3COO—) |
B.分别加入10.00 mL NaOH溶液时,测得醋酸反应后所得溶液pH=6,则溶液中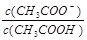 >1 >1 |
| C.当两种溶液的pH均等于7时,两种酸所消耗NaOH溶液体积不相等,醋酸消耗的NaOH溶液体积多 |
| D.加入20.00 mL NaOH溶液时,所得两种溶液中:c(Cl‾)<c(CH3COO—) |
实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙(其pH变色范围为3.1~4.4)作指示剂,下列操作中可能使测定结果偏低的是
| A.酸式滴定管在装酸液前未用标准盐酸润洗2~3次 |
| B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 |
| C.锥形瓶溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度 |
| D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 |
下列说法正确的是
| A.100℃时,Kw=10-12,此温度下pH=6的溶液一定显酸性 |
B.25℃时,0.1 mol/L的NaHSO3溶液pH=4,说明 在水溶液中只存在电离平衡 在水溶液中只存在电离平衡 |
| C.NH4Cl、CH3COONa、NaHCO3、NaHSO4溶于水,对水的电离都有促进作用 |
| D.25℃时,10 mL0.1 mol/LCH3COOH溶液与5 mL0.1 mol/LNaOH溶液混合,所得溶液中有2c(Na+)=c(CH3COO-)+c(CH3COOH) |
向1000mL3mol·L-1NaOH中通入适量CO2气体,溶液中有关阴离子的物质的量变化曲线如图所示:
下列说法张正确的是
| A.水的电离程度一直增大 |
| B.溶液的pH逐渐下降 |
| C.M、N两点对应的溶液中离子种类不同 |
| D.CD段反应的离子方程式为OH-+CO2=HCO3- |
常温下,下列关于电解质溶液的说法正确的是
| A.将pH=4的CH3COOH溶液加水稀释10倍,溶液中各离子浓度均减小 |
| B.用 CH3COOH溶液滴定等物质的量浓度的NaOH溶液至pH=7,V(CH3COOH溶液)<V(NaOH溶液) |
| C.向0.2 mol/L的盐酸溶液中加入等体积0.1 mol·L-1 NH3·H2O溶液:c(Cl–)+c(OH–)=c(H+)+c(NH3·H2O) |
| D.在含0.1mol NaHSO4的溶液中:c(H+)=c(SO42-)+c(OH–) |
有关下列两种溶液的说法中,不正确的是
①0.2 mo1·L-1 CH3COONa溶液 ②0.1 mo1·L-1H2SO4溶液
| A.相同温度下,溶液中水的电离程度:①>② |
| B.向①加水后所得溶液c(CH3COO-)/c(CH3COOH)的比值变大 |
| C.等体积混合溶液①和溶液②,所得溶液中2c(SO42-) = c(Na+) |
| D.25℃时,向溶液②中滴加溶液①至pH = 7,溶液中c(Na+) >c(CH3COO-) + c(SO42-) |
下列图象表达正确的是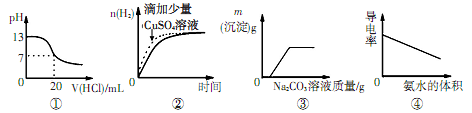
| A.图①表示25℃时, 用0.1mol·L-1盐酸滴定20mL 0.1mol·L-1NaOH溶液 |
| B.图②表示常温下, 两份足量、 等浓度的盐酸与等量锌粉反应时, 其中一份滴加了少量硫酸铜溶液 |
| C.图③表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 |
| D.图④表示向醋酸溶液中滴入氨水 |
室温下,下列溶液中微粒浓度关系一定正确的是
| A.H2SO4溶液中:C(H+)="=" C(SO42-)+ C(HSO4-)+ C(OH-) |
| B.氨水中:C(NH4+)="=" C(OH-)>C(H+) |
C.a mol·L-1的醋酸与0.01 mol·L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的 |
| D.0.1 mol·L-1的盐酸与0.2 mol·L-1氨水等体积混合后,溶液中:C(OH-)+ C(Cl-)="=" C(H+)+ C(NH3·H2O) |
下列选项中的数值前者小于后者的是
| A.25℃和l00℃时H2O的KW |
| B.同温同浓度的KHCO3溶液和NH4HCO3,溶液中的c(HCO3-) |
| C.同温同浓度的NaHCO3溶液和CH3COONa溶液的pH |
| D.中和25mL0.1mol/L NaOH溶液所需CH3COOH和HCl的物质的量 |
下列比较中,正确的是
| A.常温下,同浓度的一元酸HA比HB易电离,则相同浓度的NaA溶液比NaB溶液的pH大 |
| B.0.2mol/L,NH4NO3和0.1mol/L NaOH溶液等体积混合后:c(NH4+)>c(NO3-)>c(Na+) >c(OH-)>c(H+) |
| C.物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(CH3COOH) |
| D.同浓度的下列溶液:①NH4Al(SO4)2 ②NH4Cl ③NH3·H2O ④CH3COONH4,其中c(NH4+)由大到小的是:①>②>④>③ |
下列有关说法正确的是
A.已知I2可溶于KI形成KI3,向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀,说明KI3溶液中存在平衡:I3— I2+I— I2+I— |
| B.物质的量浓度相等的H2CO3和Na2CO3溶液等体积混合后的溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| C.已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积的浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生 |
| D.25 ℃时,溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14 |
某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,
下列有关说法正确的是
| A.加等量的水后硫酸中水电离出的C(H+)与硫酸铝中水电离出的C(H+)的比值比稀释前的比值增大 |
| B.a点溶液中有:c(H+)+c(Al3+)=c(OH-)+c(SO42一) |
| C.体积和pH都相同的稀硫酸和硫酸铝溶液与等浓度的NaOH反应,消耗NaOH的体积相等 |
| D.b、c两溶液水电离出的c(OH-)相等。 |
25 ℃时,关于①O.l mol·L-1的NH4Cl溶液②0.1 mol·L-1的NaOH溶液,下列叙述正确的是
| A.若向①中加适量水,溶液中c(Cl-)/c(NH4+)的值减小 |
| B.若向②中加适量水,水的电离平衡正向移动 |
| C.若将①和②均稀释100倍,①的pH变化更大 |
| D.若将①和②混合,所得溶液的pH=7,则溶液中的c(NH3·H2O)>c(Na+) |
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是
| A.当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系: c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
| C.H2A第一步电离的方程式为H2A→HA- +H+ |
| D.向NaHA溶液加入水稀释的过程中,pH可能增大也可能减少 |
下列关于各图象的解释或得出的结论正确的是
| A.图1表示用0.10 mol·L-1 NaOH溶液滴定20.00 mL 0.10 mol·L-1醋酸溶液的滴定曲线 |
| B.图2表示乙酸溶液中通入氨气至过量过程中溶液导电性I的变化 |
| C.根据图3所示可知:石墨比金刚石稳定 |
D.图4表示反应2SO2+O2 2SO3,t1时刻只减小了的SO3的浓度 2SO3,t1时刻只减小了的SO3的浓度 |
试题篮
()