下列不属于水解反应的是
A.NH4+ + H2O NH3·H2O + H+ NH3·H2O + H+ |
B.MgCl2 + 2H2O Mg(OH)2+ 2HCl Mg(OH)2+ 2HCl |
C.HCO3―+ H2O CO32- + H3O+ CO32- + H3O+ |
D.ClO- + H2O HClO +OH- HClO +OH- |
把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液等体积混合,则混合溶液中微粒浓度关系正确的是
| A.c(CH3COO-)>c(Na+) |
| B.c(CH3COOH)>c(CH3COO-) |
| C.2c(H+)= c(CH3COO-) – c(CH3COOH) |
| D.c(CH3COOH)+ c(CH3COO-)=0.02mol/L |
下列有关物质应用的说法正确的是
| A.碳酸钠溶液呈碱性,可用热的纯碱溶液除去矿物油污渍 |
| B.钠和钾的合金在常温下是液体,可用于快中子反应堆作热交换剂 |
| C.常温下,浓硝酸不跟铁发生化学反应,可用铁制容器盛装浓硝酸 |
| D.铝表面易形成致密的氧化膜,铝制器皿可长时间盛放咸菜等腌制食品 |
25℃时,下列有关电解质溶液中微粒的关系不正确的是
| A.pH=4的氯化铵溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| B.pH=3的氯化铵溶液中: c(OH-)=1.0×10-11mol·L-1 |
| C.将pH=5的醋酸溶液稀释后,恢复至原温度,pH和Kw均增大 |
| D.向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+) = c(SO42-) >c(NH4+) >c(H+) > c(OH-) |
某温度下,0.02mol·L-1NaHSO3溶液的pH=3。下列说法正确的是
| A.加水稀释10倍后,溶液的pH=4 |
| B.c(SO32-)+c(OH-)=c(H2SO3)+c(HSO3-) |
| C.2c(SO32-)+c(HSO3-)+c(H2SO3)=0.02mol·L-1 |
| D.c(H+)×c(SO32-)/c(HSO3-)约为5×10-5mol·L-1 |
下列说法正确的是
A.在Na2S溶液中: |
B.乙烯的燃烧热为 ,则乙烯燃烧的热化学方程式可表示为: ,则乙烯燃烧的热化学方程式可表示为: |
C.钢铁发生吸氧腐蚀的正极反应式为: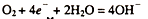 |
D.从酸化的海带灰浸出液中提取碘: |
常温下,对于pH=11的NaOH溶液,下列说法错误的是
A.c(OH-)=c(Na+)+c(H+)
B.该溶液中的c(OH-)=1.0x10-3mol·L-1
C.加水稀释104倍所得溶液显碱性
D.D.与pH=3的HF溶液等体积混合所得溶液:c(Na+)=c(F-)+c(HF)
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.0.1 mol·L-1MgCl2溶液中含有的Mg2+数目一定小于0.1NA |
| B.标准状况下,11.2 L CCl4中含有的分子数目为0.5NA |
| C.28 g聚乙烯中含有的碳原子数目为2NA |
| D.1 mol CH3+中含有的电子数目为11NA |
常温下,下列说法正确的是
| A.往CH3COOH溶液中加水,c(OHˉ)和c(H+)均增大 |
| B.物质的量浓度均为0.1mol•Lˉ1的CH3COOH溶液和NaOH溶液等体积混合,c(Na+)<c(CH3COOˉ) |
| C.某浓度的氯化铵溶液中存在c(NH4+)>c(Clˉ)>c(H+)> c(OHˉ) |
| D.在pH=4的氯化铵溶液中c(H+)+ c(NH4+)= c(Clˉ)+ c(OHˉ) |
pH=3的盐酸和pH=11的氨水等体积混合,溶液中离子浓度关系正确的是
| A.c(NH4+)>c(Cl-)>c(H+)>c(OH-) | B.c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| C.c(Cl-)>c(NH4+)>c(H+)>c(OH-) | D.c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
物质的量浓度都是0.1mol/L的CH3COOH和CH3COONa混合溶液,已知其中c(CH3COO-)>c(Na+),对该溶液的下列判断正确的是
| A.c(H+)<c(OH-) |
| B.c(CH3COOH)+c(CH3COO-)=0.2mol/L |
| C.c(CH3COOH) >c(CH3COO-) |
| D.c(CH3COO-)+ c(OH-)=0.1mol/L |
下列关于25℃的NaHCO3溶液的相关事实,能够证明H2CO3为弱酸的是
| A.溶液中存在CO32- | B.溶液中c(Na+)>c(CO32-) |
| C.与等物质的量的NaOH恰好中和 | D.溶液中c(H+)·c(OH-)=10-14 |
常温下,体积相同,浓度均为0.1mol/L的苯酚钠、碳酸氢钠、碳酸钠、醋酸钠四种溶液pH最大的是
| A.苯酚钠溶液 | B.碳酸氢钠溶液 |
| C.碳酸钠溶液 | D.醋酸钠溶液 |
下列叙述正确的是
| A.0.1 mol/L CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B.Na2CO3溶液加水稀释后,恢复至原温度,pH和KW均减小 |
| C.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等 |
| D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降 |
已知:常温下浓度为0.1 mol·L-1的下列溶液的pH如表:
| 溶质 |
NaF |
NaClO |
Na2CO3 |
| pH |
7.5 |
9.7 |
11.6 |
下列有关说法正确的是
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B.若将CO2通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中2 c (CO32ˉ)+ c (HCO3ˉ)=" 0.1" mol·L-1
C.根据上表,水解方程式ClOˉ+ H2O HClO + OHˉ的平衡常数K≈10ˉ7.6
HClO + OHˉ的平衡常数K≈10ˉ7.6
D.向上述NaClO 溶液中通HF气体至恰好完全反应时:C(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
试题篮
()