下列说法正确的是( )
| A.相同温度下,1 mol·L-1醋酸溶液与0.5 mol·L-1醋酸溶液中,c(H+)之比是2∶1 |
| B.向醋酸钠溶液中加入适量醋酸,使混合液的pH=7,此时混合液中c(Na+)=c(CH3COO-) |
| C.pH=3的盐酸和醋酸加水使溶液体积分别扩大100倍,pH仍相同 |
| D.0.1 mol·L-1NH4Cl溶液中c(NH4+)+c(H+)=c(Cl-) |
常温时,将V1mL C1 mol·L-1的醋酸滴加到V2mL C2 mol·L-1的烧碱溶液中,下列结论正确的是( )
| A.若V1=V2,且混合溶液pH<7,则有C1<C2 |
| B.若V1=V2,C1=C2,则混合溶液中c(Na+)=c(CH3COO-) |
| C.若混合溶液的pH=7,则有C1V1>C2V2 |
| D.若混合溶液的pH=7,则混合溶液中c(Na+)>c(CH3COO-) |
向20 mL氢氧化钠溶液中逐滴加入0. 2 mol/L醋酸溶液,滴定曲线如下图所示下列说法不正确的是 ( ) 
| A.该氢氧化钠溶液的物质的量浓度为0.1 mol/L . |
| B.在b点,c (Na+)=c(CH3COO-) |
| C.在d点,溶液中所有离子浓度由大到小的顺序为 c (CH3COO-)>c (Na+)>c (H+)>c (OH-) |
| D.氢氧化钠溶液与醋酸溶液恰好完全反应的点位于曲线b、d间的某点 |
已知常温下,0.1mol/L的一元酸HA溶液的pH>1;0.1mol/L的一元碱MOH溶液中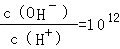 ,将此两种溶液等体积混合,混合夜中,离子浓度关系不正确的是( )
,将此两种溶液等体积混合,混合夜中,离子浓度关系不正确的是( )
A.c(OH﹣)=c(HA)+c(H+)
B.c(M+)>c(A﹣)>c(OH﹣)>c(H+)
C.c(A﹣)>c(M+)>c(H+)>c(OH﹣)
D.c(M+)+c(H+)=c(A﹣)+c(OH﹣)
25℃时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L HA酸溶液,溶液pH变化曲线如下图所示,仔细观察下图,判断有关说法中不正确的是( )
A.HA酸是弱酸
B.当滴定过程中溶液pH=7时,c(Na+)=c(A-)>c(OH-)=c(H+)
C.在C点:c(Na+)>c(A-)>c(H+)>c(OH-)
D.在D点:c(A-)+c(HA)=2c(Na+)
已知 25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25℃) |
1.8×10-5 |
4.9×10-10 |
Ka1=4.3×10-7 Ka2=5.6×10-11 |
则下列说法正确的是( )
A.等物质的量浓度的各溶液 pH 关系为:pH ( NaCN)>pH(Na2CO3)>pH( CH3COONa)
B.浓度均为0.2mol/LNaHCO3和 Na2CO3溶液中,存在的粒子种类不相同
C.0.4 mol·L-1HCN 溶液与 0.2 mol·L-1NaOH 溶液等体积混合后,所得溶液中:c(Na+)>c(OH-)>c(H+)
D.25℃时,pH=4且浓度均为0.1 mol·L-1的 CH3COOH、CH3COONa混合溶液中:
c(Na+)+c(H+)>c(CH3COO-)+c(CH3COOH)
室温时,向20 mL 0.1 mol/L的醋酸溶液中不断滴入0.1 mol/L的NaOH溶液,溶液的pH变化曲线如图所示。在滴定过程中,关于溶液中离子浓度大小关系的描述正确的是
| A.a点时:c(CH3COOH) >c(CH3COO-) >c(H+) >c(Na+) >c(OH-) |
| B.b点时:c(Na+)=c(CH3COO-) |
| C.c点时:c(H+)=c(CH3COOH)+c(OH-) |
| D.d点时:c(Na+) >c(OH-) > c(CH3COO-) >c(H+) |
Na2CO3溶液中存在水解平衡:CO32-+H2O  HCO3-+OH-。下列说法错误的是
HCO3-+OH-。下列说法错误的是
| A.加水稀释,溶液中所有离子的浓度都减小 | B.通入CO2,溶液pH减小 |
C.加入NaOH固体,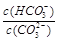 减小 减小 |
D.升高温度,平衡常数增大 |
25 ℃时,在25 mL 0.1 mol/L的NaOH溶液中,逐滴加入0.2 mol/L的CH3COOH溶液,溶液的pH变化如下图所示,下列分析的结论中正确的是( )
A.B点的横坐标a=12.5
B.C点时溶液中有:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.D点时溶液中有:c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.曲线上A、B间的任意一点,溶液中都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
对于0.1 mol·L-1 Na2SO3溶液,正确的是
| A.升高温度,溶液pH降低 |
| B.c(Na+) = 2c(SO32-) + c(HSO3-) + c(H2SO3) |
| C.c(Na+) + c(H+) =2c(SO32-) + 2c(HSO3-) + c(OH-) |
| D.加入少量NaOH固体,c(SO32-)与c(Na+)均增加 |
已知25 ℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25 ℃) |
1.8×10-5 |
4.9×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1HCN溶液与b mol·L-1NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.冰醋酸中逐滴加水,则溶液的导电性、电离度均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HCO)+2c(CO)
室温下,下列混合溶液中,各离子浓度的关系正确的是( )
| A.浓度均为0.1mol·L-1的小苏打溶液与烧碱溶液等体积混合: 2c(CO32-)+c(OH-)+c(HCO3-)—c(H+)=0.1mol·L-1 |
| B.浓度均为0.1mol·L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合 c(SO42-)>c(Na+)>c(NH4+)>c(H+)>c(OH-) |
| C.pH=12的氨水与pH =2的盐酸等体积混合 c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D.浓度均为0.1mol·L-1的醋酸溶液与氢氧化钠溶液等体积混合 |
c(Na+)=c(CH3COO-)>c(OH—)=c(H+)
常温下,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液②NaOH溶液③CH3COONa溶液,下列说法中不正确的是(忽略混合前后溶液体积变化)…………………( )
| A.溶液的pH值:②>③>① |
| B.水电离出的c(OH-):③>①>② |
| C.①和②等体积混合后的溶液:c(CH3COOH)+ c(CH3COO-)=0.1mol/L |
| D.②和③等体积混合后的溶液:c(Na+)+ c(H+)=c(OH-)+c(CH3COO-) |
25OC时,下列溶液中有关微粒的物质的量浓度关系错误的是( )
| A.pH=2的HA溶液与pH=12的MOH溶液以任意比混合:[H+]+[M+]=[OH-]+[A-] |
| B.pH=4的NaHA溶液:[HA-]>[H+]>[H2A]>[A2-] |
| C.将醋酸钠、盐酸两溶液混合后呈中性的溶液中:[Na+]=[CH3COO-]+[CH3COOH] |
| D.氨水和氯化铵的混合溶液,可能会出现[NH4+]>[OH-]>[Cl-]>[H+] |
试题篮
()