空气中CO2含量偏高会产生温室效应,也会对人体健康造成影响;CO2的用途广泛,合理使用则可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)一定条件下CO2可制得Na2CO3、NaHCO3等。
①等物质的量浓度的Na2CO3、NaHCO3溶液,碱性前者 后者(填“>”“<”或“=”)。
②有下列五种物质的量浓度均为0.1mol/L的电解质溶液,将其稀释相同倍数时,其中pH变化最大的是 (填字母编号)。
| A.Na2CO3 |
| B.NaHCO3 |
| C.NaAlO2 |
| D.CH3COONa |
E.NaOH
(2)已知反应Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ/mol,测得在不同温度下,
FeO(s)+CO(g) ΔH=a kJ/mol,测得在不同温度下,
该反应的平衡常数K随温度的变化如下:
| 温度(℃) |
300 |
500 |
700 |
| K |
3.00 |
3.47 |
4.40 |
上述反应中a_______0(填“>”、“<”或“=”);在2L密闭容器中300℃下进行反应,若Fe和CO2的起始量均为4 mol,当达到平衡时CO2的转化率为________。
(3)目前工业上可以用CO2和H2在230℃、催化剂条件下反应生成甲醇蒸汽和水蒸气。下图为恒压容器中0.5 mol CO2和1.5 mol H2反应转化率达80%时的能量变化示意图。则该反应的热化学方程式为 。
(4)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。下图是制备HCOOH的示意图,根据要求回答问题: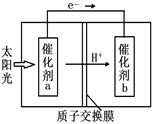
①催化剂b表面的电极反应式为 。
②经测定,若每分钟通过质子交换膜的H+的物质
的量为40mol,则每小时可产生O2 Kg。
NaHSO3被用于棉织物及有机物的漂白以及在染料、造纸、制革等工业中用作还原剂。
(1)NaHSO3可由NaOH溶液吸收SO2制得。
2NaOH(aq) + SO2(g) = Na2SO3(aq) + H2O(l),△H1
2NaHSO3(aq) = Na2SO3(aq) + SO2(g)+ H2O(l),△H2
则反应SO2(g) + NaOH(aq) = NaHSO3(aq) 的△H3 = (用含△H1、△H2式子表示);且△H1 ______△H2(填“>”、“<”和“=”)。
(2)NaHSO3在不同温度下均可被KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如下左图。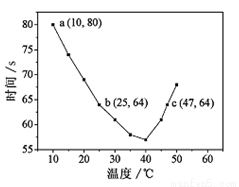
①a点时,v(NaHSO3)= mol·L-1·s-1。
②根据图中信息判断反应:I2 +淀粉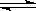 蓝色溶液的△H 0(填“>”、“<”或“=”)。
蓝色溶液的△H 0(填“>”、“<”或“=”)。
③10-40℃区间内,显色时间越来越短,其原因是 。
(3)已知:T℃时H2SO3的Ka1=1.5×10-2, Ka2=1.0×10-7;NaHSO3溶液pH<7。
在T℃时,往NaOH溶液中通入SO2。
①在NaHSO3溶液中加入少量下列物质后,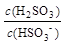 的值增大的是 。
的值增大的是 。
| A.H2O | B.稀H2SO4 | C.H2O2溶液 | D.NaOH溶液 |
②某时刻,测得溶液的pH=6,则此时,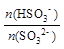 = 。
= 。
③请画出从开始通入SO2直至过量时,溶液中n(SO32-)∶n(HSO3-)随pH的变化趋势图 。
(17分)I.将0.40mol N2O4气体充入2L固定容积的密闭容器中发生如下反应:
N2O4(g)  2NO2(g)△H。在Tl℃和T2℃时,测得NO2的物质的量随时间变化如下图所示:
2NO2(g)△H。在Tl℃和T2℃时,测得NO2的物质的量随时间变化如下图所示:
(1)Tl℃时,40s~80s内用N2O4表示该反应的平均反应速率为_________________mol/(L·s)。
(2)△H___________O(填“>”、“<”或“=”)。
(3)改变条件重新达到平衡时,要使 的比值变小,可采取的措施有__________(填序号)。
的比值变小,可采取的措施有__________(填序号)。
a.增大N2O4的起始浓度 b.升高温度
c.向混合气体中通入NO2 d.使用高效催化剂
II.已知:常温下,HCN的电离常数为Ka=5×10-10。
(4)有浓度相同的HCN和NaCN的混合溶液。
①通过计算说明该溶液的酸碱性_____________________________________________。
②该溶液中各离子的浓度由大到小的顺序是___________________________________。
(5)常温下,向某浓度的HCN溶液中逐滴加入NaOH溶液至溶液呈中性。
①该过程溶液中水的电离程度的变化为______________。
②若混合溶液中c(Na+)="a" mol/L,则c(HCN)=_________mol/L。
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。

完成下列填空:
27.写出电解饱和食盐水的离子方程式。
28.离子交换膜的作用为:、。
29.精制饱和食盐水从图中位置补充,氢氧化钠溶液从图中位置流出(选填"a"、"b"、"c"或"d")。
30.可以和草酸(
)、硫酸反应生成高效的消毒杀菌剂
,还生成
和
等物质。
写出该反应的化学方程式。
31.室温下,0.1 mol/L 溶液的pH0.1 mol/L
溶液的pH(选填"大于"、"小于"或"等于")。浓度均为0.1 mol/L 的
和
的混合溶液中,
、
、
、
浓度从大到小的顺序为。
已知: Ki1=1.54×10-2 Ki2=1.02×10-7
Ki1=2.95×10-8
Ki1=4.3×10-7 Ki2=5.6×10-11
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
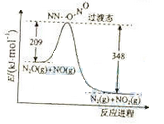
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2,其△H= kJ·mol-1。
(本题共12分)Na2S2O3、Na2S、Na2SO3等含硫化合物在工业上有广泛的用途。
完成下列填空:
28.若将Na2S2O3中的硫元素看作为+2价,下列反应中与Na2S2O3+H2SO4(稀) → Na2SO4+S↓+SO2↑+H2O属于同一类型的是_______(填序号)。
a.2H2S+SO2→ 3S↓+2H2O
b.3NaClO 2NaCl+NaClO3
2NaCl+NaClO3
c.S+2H2SO4(浓)  3SO2↑+2H2O
3SO2↑+2H2O
d.4P+3NaOH+3H2O → 3NaH2PO2+PH3↑
29.棉织物用氯气漂白后,加入Na2S2O3除去余氯时,发生如下反应:
____S2O32―+____Cl2+________ → ___SO42―+___Cl―+___H+
完成并配平该反应方程式;若反应中生成0.2 mol SO42―,则转移电子___________mol。
30.下图是Na2SO3溶液中各离子浓度的相对大小关系示意图。其中,②是_______,④是______(填微粒符号)。
31.已知Na2S溶液显碱性,其主要原因是_________________(用离子方程式解释)。往装有Na2S溶液的烧杯中加入足量的ZnCl2溶液,产生白色的ZnS沉淀;再向烧杯中滴加CuCl2溶液,沉淀转变为黑色。请用溶解平衡原理解释上述现象______________________________________。
(本题共12分)
27.硫元素位于元素周期表第____列;硫元素原子核外有2个未成对电子,这2个电子所处亚层的符号是_______;硫、氯元素的原子均可形成与Ar原子电子层结构相同的简单离子,且硫离子的半径更大,请解释______________________________________。
28.S8和P4的分子中都只有共价单键,若P4分子中有6个P-P键,则可推断S8分子有________个S-S键;
己知:H-S键键能:339 kJ/mol; H-Se键键能:314kJ/mol。以上键能数据能否比较S,Se非金属性的强弱_______(选填“能”、“否”;下同);能否比较H2S、H2Se沸点的高低_______。
29.在25℃,Na2SO3溶液吸收SO2得到的NaHSO3溶液中c(SO32-)>c (H2SO3),据此断NaHSO3溶液显_____性。
30.在25℃,Na2SO3溶液吸收SO2后,若溶液pH=7.2,则溶液中c(SO32- )=c(HSO3-);若溶液pH=7,则以下浓度关系正确的是(选填编号)_____________________。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)= c(OH-)
c.c(Na+)+ c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
31.己知Na2SO3溶液中存在水解平衡:SO32-+H2O HSO3-+OH-,请用Na2SO3溶液和a试剂及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程。a试剂是________,操作和现象是___________.
HSO3-+OH-,请用Na2SO3溶液和a试剂及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程。a试剂是________,操作和现象是___________.
(18分)C、N、S是重要的非金属元素,按要求回答下列问题:
(1)烟道气中含有的CO和SO2是重要的污染物,可在催化剂作用下将它们转化为S(s)和CO2,此反应的热化学方程式为______________________________________。
已知:CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1;S(s)+O2=SO2(g) △H=-296.0 kJ·mol-1
(2)向甲、乙两个均为1L的密闭容器中,分别充入5mol SO2和3mol O2,发生反应:2 SO2 (g)+O2 (g) 2 SO3 (g) △H<0。甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6mol。则T1________T2(填“>”“<”),甲容器中反应的平衡常数K=___________。
2 SO3 (g) △H<0。甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6mol。则T1________T2(填“>”“<”),甲容器中反应的平衡常数K=___________。
(3)如图所示, A是恒容的密闭容器,B是一个体积可变的充气气囊。保持恒温,关闭K2,分别将1 mol N2和3mol H2通过K1、K3充入A、B中,发生的反应为N2(g)+3H2(g)  2NH3(g),起始时A、B的体积相同均为a L。
2NH3(g),起始时A、B的体积相同均为a L。
①下列示意图正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是___。
②容器A中反应到达平衡时所需时间t s,达到平衡后容器的压强变为原来的5/6,则平均反应速率v(H2)=____。
(4)将0.1mol氨气分别通入1L pH=1的盐酸、硫酸和醋酸溶液中,完全反应后三溶液中NH4+离子浓度分别为c1、c2、c3,则三者浓度大小的关系为_______ (用c1、c2、c3和>、<、=表示)。已知醋酸铵溶液呈中性,常温下CH3COOH的Ka=1×10-5 mol·L-1,则该温度下0.1 mol·L-1的NH4Cl溶液的pH为_________。
对气体的转化与吸收的研究,有着实际意义。
(1)一定条件下,工业上可用CO或CO2与H2反应生成可再生能源甲醇,反应如下:
3H2(g)+CO2(g) CH3OH(g)+H2O(g) △H1=-49.0KJ/mol K1(Ⅰ)
CH3OH(g)+H2O(g) △H1=-49.0KJ/mol K1(Ⅰ)
2H2(g)+CO(g) CH3OH(g) △H2=-90.8KJ/mol K2(Ⅱ)
CH3OH(g) △H2=-90.8KJ/mol K2(Ⅱ)
则CO(g)+H2O(g) CO2(g)+H2(g)的△H3= KJ/mol和K3= (用K1和K2表示)
CO2(g)+H2(g)的△H3= KJ/mol和K3= (用K1和K2表示)
(2)在一定温度下,将0.2mol CO2和0.8mol H2充入容积为2L的密闭容器中合成CH3OH(g)。
5min达到平衡时c(H2O)=0.025mol/L,则5min内v(H2)= _______mol/(L·min)。下图图像正确且能表明该反应在第5min时一定处于平衡状态的是______。
若改变某一条件,达到新平衡后CO2的浓度增大,则下列说法正确的是_______。
a.逆反应速率一定增大 b.平衡一定向逆反应方向移动
c.平衡常数不变或减小 d.CO2的物质的量可能减小
(3)反应II可在高温时以ZnO为催化剂的条件下进行。实践证明反应体系中含少量的CO2有利于维持ZnO的量不变,原因是_________(写出相关的化学方程式并辅以必要的文字说明;已知高温下ZnO可与CO发生氧化还原反应)。
(4)实验室里C12可用NaOH溶液来吸收。室温下,若将一定量的C12缓缓通入0.2mol/L NaOH溶液中,恰好完全反应得溶液A,反应过程中水的电离程度________(填“变大”、“变小”或“不变”,下同), _________。溶液B为0.05mol/L的(NH4)2SO4溶液,则A、B两溶液中c(ClO-)、c(Cl-)、c(NH4+)、c(SO42-)由大到小的顺序为_________(已知:室温下HClO的电离常数Ka=3.2×10-8, NH3·H2O的电离常数Kb=1.78×10-5)。
_________。溶液B为0.05mol/L的(NH4)2SO4溶液,则A、B两溶液中c(ClO-)、c(Cl-)、c(NH4+)、c(SO42-)由大到小的顺序为_________(已知:室温下HClO的电离常数Ka=3.2×10-8, NH3·H2O的电离常数Kb=1.78×10-5)。
铁及其化合物有着广泛用途。
(1)将饱和三氯化铁溶液滴加至沸水中可制取氢氧化铁胶体,写出制取氢氧化铁胶体的化学方程式 。
(2)含有Cr2O72-的废水有毒,对人畜造成极大的危害,可加入一定量的硫酸亚铁和硫酸使Cr2O72-转化为Cr3+,该反应的离子方程式为 。然后再加入碱调节溶液的pH在6-8 之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去。
(3)铁镍蓄电池又称爱迪生蓄电池,放电时的总反应为Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,充电时阳极附近的pH (填:降低、升高或不变),放电时负极的电极反应式为 。
(4)氧化铁是重要的工业原料,用废铁屑制备氧化铁流程如下: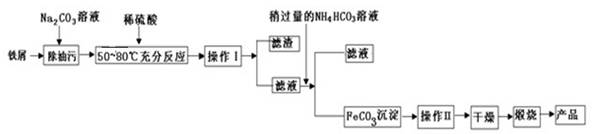
①铁屑溶于稀硫酸温度控制在50~800C的主要目的是 。
②写出在空气中煅烧FeCO3的化学方程式为 。
③FeCO3沉淀表面会吸附S042-,需要洗涤除去。
洗涤FeCO3沉淀的方法是 。
判断沉淀是否洗净的方法是 。
(14分)氨是重要的化工原料,可以制尿素等多种产品
(1)合成氨所用的氢气可以甲烷为原料制得,有关化学反应的能量变化如下图所示。
(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合亚铜溶液来吸收原料氕中CO,其反应原理为:
[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g) [Cu(NH3)3]CH3COO·CO(l)
[Cu(NH3)3]CH3COO·CO(l)  H<0,吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 (填写选项编号)。
H<0,吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 (填写选项编号)。
A.高温、高压 B.高温、低压
C.低温、低压 D.低温、高压
(3)氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) △H<0,某温度下,向容器为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%。该温度下次反应的平衡常数K为 。
CO(NH2)2(l)+H2O(g) △H<0,某温度下,向容器为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%。该温度下次反应的平衡常数K为 。
(4)取两个相同的恒容容器,保持相同温度,并加入等量的CO2气体,根据实验数据绘制出(NH3)随时间(t)变化的曲线如图所示,若A、B分别为不同温度时测定的曲线,则____(填“A”或“B”)曲线所对应的实验温度高,判断的依据是 。
(5)已知某些弱电解质在水中的电离平衡常数(25 ℃)如下表:
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是 。
A.c(NH4+ )>c(CO32-)>c(HCO3- )>c(NH3·H2O)
B.c(NH4+ )+c(H+)=c(HCO3- )>c(OH-)+ c(CO32-)
C.c(HCO3- )+c(H2CO3)+ c(CO32-)="0.1" mol·L-1
D.c(NH4+ )+c(NH3·H2O)=2c(CO32-)>2c(HCO3- )+ 2c(H2CO3)
常温下,如果取0.1mol·L-1HCl溶液与0.1mol·L-1MOH溶液等体积混合(不计混合后溶液体积的变化),测得混合液的pH=5,请回答下列问题:
(1)混合后溶液的pH=5的原因(用离子方程式表示):
(2)混合溶液中由水电离出的H+浓度是0.1mol·L-1HCl溶液中由水电离出的H+浓度的 倍。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):
C(Cl-)-c(M+)= mol·L-1,c(H+)-c(MOH)= mol·L-1。
(4)已知CH3COOM溶液为中性,HF常温下电离常数为6.8×10-4,CH3COOH电离常为1.7×10-5。
则MF溶液的pH 7(填<、>、=);将同温下等物质的量浓度的四种盐溶液:
| A.MHCO3 | B.CH3COOM | C.MClO | D.MCl |
按pH由小到大的顺序排列: (填序号)。
(7分)按要求回答下列问题:
(1)向CH3COOH水溶液中加入水,平衡CH3COOH  H++CH3COO—将向 (填“正反应方向”、“逆反应方向”或“不”)移动,达到新的平衡状态时,溶液中c(CH3COO-)与原平衡时相比 (填“增大”、“减小”或“不变”),溶液中c(OH-) 与原平衡时相比 (填“增大”、“减小”或“不变”)。
H++CH3COO—将向 (填“正反应方向”、“逆反应方向”或“不”)移动,达到新的平衡状态时,溶液中c(CH3COO-)与原平衡时相比 (填“增大”、“减小”或“不变”),溶液中c(OH-) 与原平衡时相比 (填“增大”、“减小”或“不变”)。
(2)K通常表示化学平衡常数,对于反应Cl2+ H2O H++Clˉ+HClO其化学平衡常数K的表达式为: 。
H++Clˉ+HClO其化学平衡常数K的表达式为: 。
(3)下列说法中正确的是 。
| A.pH=1和pH=2的盐酸,c(H+)之比为1︰2 |
| B.某溶液中存在的离子只有Cl-、OH-、NH4+、H+,该溶液中离子浓度大小关系不可能为c(Cl-) > c(H+) > c(NH4+)>c(OH一) |
| C.0.1 mol·L-1的NaHCO3溶液中: c(Na+)>c(HCO3-) >c(CO32-) >c (H2CO3) |
| D.升高温度,弱电解质的电离常数一定增大 |
E.某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线如图所示。II为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b
(1)将0.2mol/LHA(某一元酸)溶液与0.1mol/LNaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-),则此溶液中c(OH-)_______ c(H+), c(A-)_______c(HA);c(HA)+ c(A-)______0.1mol/L ;此溶液中由水电离出的c(OH-)______0.2mol/LHA溶液中由水电离出的c(H+)(填“>”、“<”或“=”)。
(2)将等体积pH=1的盐酸和醋酸,加入适量水,pH都升高了1,则加水后溶液体积V(醋酸)____V(盐酸)(填“>”、“<”或“=”)。
(3)常温下,某酸 (A为酸根)与某碱
(A为酸根)与某碱 溶液恰好完全反应生成正盐,该溶液
溶液恰好完全反应生成正盐,该溶液 。写出该正盐的化学式____,该盐中____离子一定能水解,其水解离子方程式为_______。
。写出该正盐的化学式____,该盐中____离子一定能水解,其水解离子方程式为_______。
(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0. 1 mol CH3COONa固体,则醋酸的电离平衡向________(填“正”或“逆”)反应方向移动;溶液中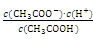 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3===CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
(3)99 ℃时,Kw=1.0×10-12,该温度下测得0.1 mol·L-1 Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为___________________。
②该温度下,将0.01 mol·L-1 H2A溶液稀释到20倍后,溶液的pH=________。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气________。
| A.盐酸多 | B.H2A多 | C.一样多 | D.无法确定 |
④将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为_____________________。
试题篮
()