(1)常温下某溶液中由水电离出的离子浓度符合c(H+)·c(OH-)=1×10-20的溶液,其pH为____________,此时水的电离受到______________。
(2)已知:2NO2(g)===N2O4(g)ΔH=-57.20 kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)===N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是__________(填字母)。
A.减小NO2的浓度 B.降低温度
C.增加NO2的浓度 D.升高温度
(3)在某温度下,H2O的离子积常数为1×10-13 mol2·L-2,则该温度下:
①0.01 mol·L-1NaOH溶液的pH=_____________;
②100 mL 0.1 mol·L-1H2SO4溶液与100 mL 0.4 mol·L-1的KOH溶液混合后,pH=___________。
(4)已知一溶液有4种离子:X+、Y-、H+、OH-,下列分析结果肯定错误的是______________。
A.c(Y-)>c(X+)>c(H+)>c(OH-) B.c(X+)>c(Y-)>c(OH-)>c(H+)
C.c(H+)>c(Y-)>c(X+)>c(OH-) D.c(OH-)>c(X+)>c(H+)>c(Y-)
(5)在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl-)。则溶液显___________(填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=________________。
(6)水溶液中的行为是中学化学的重要内容。已知下列物质的电离常数值(25 ℃):
HClO:Ka=3×10-8 HCN:Ka=4.9×10-10 H2CO3:Ka1=4.3×10-7 Ka2=5.6×10-11
84消毒液中通入少量的CO2,该反应的化学方程式为_____________________。
已知在常温下测得浓度均为0.1mol•L﹣1的下列四种溶液的pH如下表:
| 溶质 |
NaHCO3 |
Na2CO3 |
NaF |
NaClO |
| pH |
8.4 |
11.6 |
7.5 |
9.7 |
(1)用离子方程式表示NaClO溶液的pH = 9.7的原因 。
(2)根据盐溶液的pH,可知①Ka(HClO) ②Ka1(H2CO3) ③Ka(HF) ④Ka2(H2CO3)的大小顺序为 。
(3)将少量CO2通入NaClO溶液中,写出该反应的离子方程式: 。
(4)将CO2通入0.1mol•L﹣1的Na2CO3溶液中至中性,则溶液中2c(CO32-)+ c(HCO3-)= mol•L﹣1
按要求回答下列问题:
(1)实验室常用NaOH溶液来进行洗气和提纯,当100mL3mol/L的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为________________。
(2)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是______________。
A.溶液中导电粒子的数目减小
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中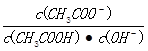 不变
不变
D.溶液中 减小
减小
(3)①常温下将0.15mol/L稀硫酸V1mL与0.1mol/LNaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=______________________(溶液体积变化忽略不计)。
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.1mol/L的下列五种溶液的pH值如表所示:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
①根据表中数据,将浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是____。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是_____________。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+CO2+H2O
(5)几种离子开始沉淀时的pH如下表:
| 离子 |
Fe2+ |
Cu2+ |
Mg2+ |
| pH |
7.6 |
5.2 |
10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,________(填离子符号)先沉淀,Ksp[Fe(OH)2]___________Ksp[Mg(OH)2](填“>”、“=”或“<”)
某些非金属单质可以与强碱溶液发生反应。例如白磷(P4)可以与过量的热NaOH溶液反应生成PH3气体和NaH2PO2(次磷酸钠)。
(1)上述反应的化学方程式为 。
(2)已知NaH2PO2水溶液pH>7,次磷酸是 元(填“一”、“二”或“三”) (填“强”或“弱”)。次磷酸的电离方程式为: ;NaH2PO2水溶液pH>7的原因: 。
(3)25℃时,向100mL0.01mol∙L-1的H3PO2溶液中,滴加等浓度的NaOH溶液至溶液呈中性,消耗NaOH溶液的体积 (填“>”、“=”或“<”)100ml。此时溶液中离子浓度由大到小的顺序是 。
硫和氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措。
(1)研究发现利用NH3可消除硝酸尾气中的NO污染。NH3与NO的物质的量之比分别为1﹕3、3﹕1、4﹕1时,NO脱除率随温度变化的曲线如图所示:
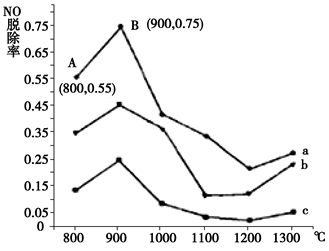
①用化学反应方程式表示NH3消除NO的反应原理 (不用注明反应条件)。
②曲线b 对应NH3与NO的物质的量之比是 。
③曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8 s,该时间段内NO的脱除速率为____ mg/(m3·s)。
(2)NO、NO2混合气体能被NaOH溶液吸收生成NaNO2和NaNO3,若吸收的溶液中N的浓度为ag·L- 1,要使1m3该溶液中的完全转化为,至少需通入标准状况下的O2 L。(用含a的代数式表示,计算结果保留整数)
(3)SO2被少许NaOH溶液吸收生成能使pH试纸变红的NaHSO3溶液,工业上可电解NaHSO3得到重要化工产品Na2S2O4。
①NaHSO3溶液中离子浓度大小为 。
②写出生成S2的电极反应式 。
(1)有下列物质①Cu ②液态SO2 ③CH3COOH ④NaHCO3 ⑤H2O ⑥熔融NaCl ⑦BaSO4属于弱电解质的是________________(填序号);
(2)常温下,0.1 mol•L-1NaHCO3溶液的pH大于8,则溶液中的Na+、HCO3-、CO32-、OH-四种微粒的浓度由大到小的顺序为:________________;NaHCO3水解的离子方程式为_____________;
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HA物质的量浓度(mol•L-1) |
NaOH物质的量浓度(mol•L-1) |
混合溶液的pH |
| a |
0.1 |
0.1 |
pH=9 |
| b |
c |
0.2 |
pH=7 |
请回答:
①从a组情况分析,HA是强酸还是弱酸____________;
②b组情况表明,c_____0.2 (选填“>”、“<”或“=”).混合溶液中离子浓度c(A-)_________c(Na+);(选填“>”、“<”或“=”)
③a组实验所得混合溶液中由水电离出的c(OH-)=_______mol•L-1。
工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Clˉ和SO42ˉ等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠的工艺流程图如下:
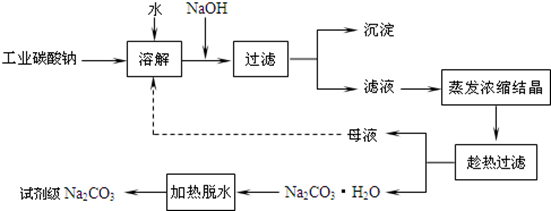
已知:碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
(1)加入NaOH溶液时发生的离子反应方程式为 、 。
(2)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释) 。
(3)“趁热过滤”时的温度应控制在 。
(4)已知:Na2CO3·10 H2O(s)=Na2CO3(s)+10 H2O(g) △H=+532.36kJ·mol—1
Na2CO3·10 H2O(s)=Na2CO3·H2O(s)+9 H2O(g) △H=+473.63kJ·mol—1
写出Na2CO3·H2O脱水反应的热化学方程式 。
(5)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用。请你分析实际生产中是否可行 ,其理由是 。
以下是处于研究阶段的“人工固氮”的新方法.N2在催化剂表面与水发生反应:
2N2(g)+6H2O(l)⇌4NH3(g)+3O2(g) △H="+" 1530.4kJ/mol;完成下列填空:
(1)该反应平衡常数K的表达式 .
(2)上述反应达到平衡后,保持其他条件不变,升高温度,重新达到平衡,则 .
a.平衡常数K增大
b.H2O的浓度减小
c.容器内的压强增大
d.v逆(O2)减小
(3)研究小组分别在四个容积为2升的密闭容器中,充入N2 1mol、H2O 3mol,在催化剂条件下进行反应3小时.实验数据见下表:
| 序号 |
第一组 |
第二组 |
第三组 |
第四组 |
| t/℃ |
30 |
40 |
50 |
80 |
| NH3生成量/(10﹣6mol) |
4.8 |
5.9 |
6.0 |
2.0 |
第四组实验中以NH3表示反应的速率是 ,与前三组相比,NH3生成量最小的原因可能是 .
(4)氨水是实验室常用的弱碱.
①往CaCl2溶液中通入CO2至饱和,无明显现象.再通入一定量的NH3后产生白色沉淀,此时溶液中一定有的溶质是 .请用电离平衡理论解释上述实验现象 .
②向盐酸中滴加氨水至过量,该过程中离子浓度大小关系可能正确的是 .
a.c(C1﹣)=c(NH4+)>c(H+)=c(OH﹣)
b.c(C1﹣)>c(NH4+)=c(OH﹣)>c(H+)
c.c(NH4+)>c(OH﹣)>c(C1﹣)>c(H+)
d.c(OH﹣)>c(NH4+)>c(H+)>c(C1﹣)
(8分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HA |
NaOH |
混合溶液的pH |
| 甲 |
[HA]=0.2 mol·L-1 |
[NaOH]=0.2 mol·L-1 |
pH=a |
| 乙 |
[HA]=c1 mol·L-1 |
[NaOH]=0.2 mol·L-1 |
pH=7 |
| 丙 |
[HA]=0.1 mol·L-1 |
[NaOH]=0.1 mol·L-1 |
pH=9 |
| 丁 |
pH=2 |
pH=12 |
pH=b |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸?________________________________________________________。
(2)c1________(填“<”、“>”或“=”)0.2 mol·L-1。乙组实验中HA和NaOH溶液混合前,HA溶液中[A-]与NaOH溶液中[Na+]的关系是________(从下面选项中选择填空)。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是__________________________,其中,[A-]=________ mol·L-1(不能做近似计算,回答准确值,结果不一定要化简)。
(4)丁组实验中,HA和NaOH溶液混合前[HA]________(填“<”、“>”或“=”)[NaOH],b________(填“<”、“>”或“=”)7。
已知25 ℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
HSCN |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数 |
1.3×10—1 |
1.8×10—5 |
4.9×10—10 |
K1=4.3×10—7 K2=5.6×10—11 |
(1)同温度下,等pH值的a.NaHCO3 b.NaCN c.Na2CO3溶液的物质的量浓度由大到小的顺序为_____________(填序号)。
(2)25℃时,将20mL 0.1mol·L-1 CH3COOH溶液和20mL 0.1mol·L-1 HSCN溶液分别与20mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:

反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:_______________。反应结束后所得两溶液中,c(SCN—) c(CH3COO—)(填“>”、“<”或“=”)
(3)若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是________(填序号)
a.c(CH3COO-) b.c(H+) c.KW d.醋酸电离平衡常数
(1)25℃时,浓度为0.1mol•L-1的6种溶液,①HCl ②CH3COOH ③Ba(OH)2 ④Na2CO3 ⑤KCl ⑥NH4Cl溶液pH由小到大的顺序为_____________(填写编号);
(2)25℃时,醋酸的电离常数Ka=1.7×10-5 mol•L-1,则该温度下CH3COONa的水解平衡常数Kh="_____" mol•L-1 (保留到小数点后一位)
(3)25℃时,pH=3的醋酸和pH=11的NaOH溶液等体积混合,溶液呈_________(“酸性”、“中性”、“碱性”),请写出溶液中的电荷守恒式:_______________。
氮和硫的化合物对大气都有严重污染,据所学化学反应原理回答下列问题:
(1)NO2与悬浮在大气中海盐粒子的相互作用时发生反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) ∆H =" a" KJ/mol
NaNO3(s)+ClNO(g) ∆H =" a" KJ/mol
则该反应为 反应(填放热或吸热),产物ClNO的结构式为 。
(2)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为 (已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数K a=1.7×10-5mol/L,可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)若将SO2,NO2,O2按4:4:3通入水中充分反应,写出总的离子方程式 。
(4)向氨水中通入过量的H2S,所得溶液M中溶质的电子式为 ;取0.2mol/L的NaOH溶液与0.1mol/L的M溶液等体积混合,加热至充分反应后,待恢复至室温,剩余溶液中离子浓度由大到小的顺序是 ,此时测得溶液的pH=12,则此条件下M溶液中阴离子的电离平衡常数Ka= (提示:若涉及多元弱酸的电离或多元弱酸根离子的水解,均只考虑第一步电离或水解)
有X、Y、Z、W四种物质的水溶液,它们分别是Na2CO3、NaOH、CH3COOH和NaCl中的一种。已知X、Y两溶液中水的电离程度相同,X、Z两溶液的pH相同,有回答下列问题:
(1)X是_______,Z是_______;
(2)Z、W两溶液中水的电离程度由大到小的顺序为 _______(用化学式表示);
(3)X、Y两溶液恰好完全反应后,溶液中各离子浓度由大到小的顺序是
(1)与明矾相似,硫酸铁也可用作净水剂,其原理为_________(用离子方程式表示)。
(2)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为___________________。
(3)已知:S2O32—有较强的还原性,实验室可用I-测定K2S2O8样品的纯度,反应方程式为S2O82—+2I-=2SO42—+I2①、I2+2S2O32-=2I-+S4O62—②。S2O82—、S4O62—、I2氧化性强弱顺序:__________。
(4)已知溶液中,还原性为HSO3—>I-,氧化性为IO3—>I2>SO42—。在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示。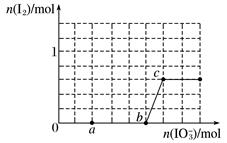
a点处的还原产物是__________(填离子符号);
b点→c点反应的离子方程式是__________________。
常温下,如果取0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液中由水电离出的c(H+)_______0.1mol/L NaOH溶液中由水电离出的c(H+) (填“>”、“<”或“=”)
(2)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断:NH4HCO3溶液的pH_______7(填“大于”、“小于”或“等于”);
(3)将同温度下等浓度的四种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
按pH由大到小的顺序排列是:__________________________(填序号)
(4) 求出混合液中下列算式的精确计算结果(填具体数字):
c(Na+)-c(A-)=_________mol/L,c(OH−)-c(HA)=_________mol/L
试题篮
()