弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问题
(1)生活中明矾常作净水剂,其净水的原理是 (用离子方程式表示)。
(2)常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合,测得混合溶液后的pH=5。写出MOH的电离方程式: 。
(3)0.1mol/L的NaHA溶液中,已知有关粒子浓度由大到小的顺序为:
c(Na+)>c(HA—)>c(H2A)>c(A2-)
①该溶液中c(H+) c(OH-)(填“>”、“<”或“=”)。
②作出上述判断的依据是 (用文字解释)。
(4)含Cr2O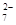 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O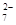 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理: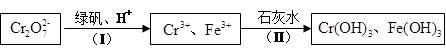
①绿矾化学式为FeSO4·7H2O。反应(I)的离子方程式为 。
②若处理后的废水中c(Cr3+)=3.0×10-6 mol·L-1,则废水中c(Fe3+)=" _________" mol·L-1。(Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH) 3]=6.0×10-31)
常温下,有浓度均为1 mol·L-1的下列4种溶液:
①H2SO4溶液 ②NaHCO3溶液 ③NH4Cl溶液 ④NaOH溶液
(1)这4种溶液pH由大到小的排列顺序是 (填序号),其中由水电离出的H+浓度最小的是 (填序号)。
(2)③中各离子浓度由大到小的顺序是 ,该温度下②中NaHCO3的水解平衡常数Kh= mol·L-1。(已知碳酸的电离常数K1=4×10-7,K2=5.6×10-11)
(3)该温度下向③中通入少量氨气,此时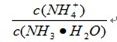 的值 (填“增大”、“减小”或“不变”)。
的值 (填“增大”、“减小”或“不变”)。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积 ④的体积(填“大于”、“小于”或“等于”)。
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈______(填“酸性”、“中性”或“碱性”,下同),溶液中c(Na+)_____c(CH3COO-)(填“>”“<”或“=”,下同)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈,溶液中c(Na+)_____c(CH3COO-)。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈______,醋酸体积______氢氧化钠溶液体积。
(4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则原醋酸溶液中c(H+)______氢氧化钠溶液中c(OH-),m与n的大小关系是m______n。
工业上制备BaCl2的工艺流程图如下: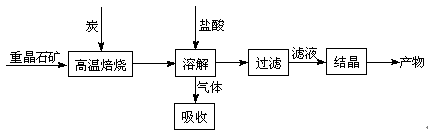
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s) 4CO(g) + BaS(s) △H1 =" 571.2" kJ·mol-1 ①
4CO(g) + BaS(s) △H1 =" 571.2" kJ·mol-1 ①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s) △H2=" 226.2" kJ·mol-1 ②
2CO2(g) + BaS(s) △H2=" 226.2" kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,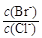 = 。
= 。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s) + CO2(g) 2CO(g)的△H2= kJ·mol-1。
2CO(g)的△H2= kJ·mol-1。
铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(主要成分为FeS2)是生产硫酸的冶炼钢铁的重要原料。高温下可发生反应:其中一个反应为:3FeS2+8O2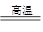 6SO2+Fe3O4,该过程若有1.5mol FeS2参加反应,则反应过程中转移_____ mol电子;
6SO2+Fe3O4,该过程若有1.5mol FeS2参加反应,则反应过程中转移_____ mol电子;
(2)氯化铝溶液显酸性,原因是_________________________(用离子方程式稀释);
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素(CO(NH2)2;它易被氧化),原理如下图所示。
①电源的负极为_________(填“A”或“B”)。
②阳极室中发生的反应依次为_________、_________。
③电解结束后,阴极室溶液的pH与电解前相比将_________;若阴极共收集到气体6.72L(标准状况),则除去的尿素为________ g(忽略气体的溶解)。
(4)为了减少CO对大气的污染,某研究性学习小组拟研究利用CO和H2O反应转化为绿色能源H2。已知:2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•moL-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•moL-1
H2O(g)═H2O(l)△H=-44.0kJ•moL-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式:_________。
(8分)物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为_______。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表示)______________。
(3)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:AgCl(s)  Ag+(aq)+Cl-(aq) 在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为__________________(填序号),此时溶液②中Cl-物质的量浓度为__________________。
Ag+(aq)+Cl-(aq) 在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为__________________(填序号),此时溶液②中Cl-物质的量浓度为__________________。
(8分)已知溶液中只存在OH-、H+、Na+、CH3COO-四种离子,试回答下列问题:
(1)若溶液中只溶解了一种溶质,则该溶质是_______,溶液中c(H+)_____c(OH-)(填“>”、“=”或“<”)。
(2)若溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则该溶液中的溶质为_____________,若溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),则该溶液中溶质为_________________。
(3)若该溶液是由体积相等的NaOH溶液和醋酸溶液混合而成,且恰好呈中性,则混合前c(NaOH) __________c(CH3COOH),混合前碱中c(OH-)和酸中c(H+)的关系c(OH-)__________c(H+)(填“>”,“=”或“<”)。
A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
| 阳离子 |
Na+、Al3+、Ba2+、NH4+ |
| 阴离子 |
Cl-、OH-、CO32-、SO42- |
分别取四种物质进行实验,实验结果如下:
①A、D溶液呈碱性,B呈酸性,C呈中性
②A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失
③A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试液变蓝
回答下列问题:
(1)A的化学式是 ,用电子式表示C的形成过程: 。
(2)向A溶液中通入适量CO2,使生成的沉淀恰好溶解,所得溶液中各离子物质的量浓度由大到小的顺序是:
(3)写出③的离子方程式
(4)简述D溶液呈碱性的理由
已知下表为25℃时某些弱酸的电离平衡常数;下图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。

(1)图像中,曲线Ⅰ表示的酸是____(填化学式);
(2)a、b、c三点中,水的电离程度由大到小的顺序是___________(用编号表示)。
(3)25℃时,NaClO溶液的水解平衡常数Kh=_______________。
(4)25℃时,NaHCO3溶液存在水解平衡,写出其水解的离子方程式
(5)0.1mol/L Na2CO3溶液中c(OH-)—c(H+)=_________(用含c(HCO3-)、c(H2CO3)的关系式表示)。
(14分)W、X、Y、Z是元素周期表中前四周期的元素,它们的原子序数依次增加。请结合下表中的信息,回答下列问题
| W |
基态原子核外有三个能级,p能级电子处在半充满状态 |
| X |
是所有元素中电负性最大的元素 |
| Y |
气态氢化物及其最高价氧化物对应的水化物均为强酸 |
| Z |
原子序数为22,被称为“未来金属” |
(1)Z位于元素周期表第_______族;该元素的基态原子价电子排布式为_____________。
(2)W与其同周期相邻的元素的第一电离能由大到小的顺序为________(填元素符号);X、Y两种元素与氢元素形成的共价键键能较大的是___________(请用元素符号表示)。
(3)X的气态氢化物的沸点在同族元素形成的气态氢化物中最_______(填“高”或“低”);已知WX3是微电子工业中优良的等离子刻蚀气体,沸点:129℃,其固态时的晶体类型为________,WX3在潮湿的空气中能与水蒸气发生氧化还原反应,反应生成的无色气体遇到空气变为红棕色,写出该反应的化学方程________。
(4)工业上制取Z的方法是:
第一步,在高温时,将金红石(ZO2)、炭粉混合并通人Y2制得ZY4和一种可燃性气体,已知(下列除Z、Y外其他都为实际元素符号)
①ZO2(s)+2Y(g)=ZY4(1)+O2(g) △H=-410.0kJ·mol-1
②CO(g)=C(s)+1/2O2(g) △H="+110.5" kJ·mol-1
则书写上述反应的热化学方程式是_________________________________________。
第二步,在氩气做保护气的环境中,用过量的金属镁在加热条件下与ZY4反应制得金属Z。
(1)将0.2mol/L HA 溶液与 0.1mol/L NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A−),则(用“>”、“<”或“=”填写下列空白):①混合溶液中c(A−)______c(HA);②混合溶液中c(HA)+c(A−)______0.1mol⋅L−1;
(2)常温时,取0.1mol•L-1 HX溶液与0.1mol•L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
①混合溶液中由水电离出的c(OH-)与0.1mol•L-1 NaOH溶液中由水电离出的c(OH-)之比为______.
②已知NH4X溶液是中性,又知将HX溶液加入到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH______7(选填“>”、“<”或“=”).
(18分)Ⅰ.(8分)次磷酸(H3PO2)是一种一元中强酸,具有较强的还原性。试回答下列问题:
(1)P的原子结构示意图为 ;
(2)NaH2PO2为 (填“正盐”或“酸式盐”),溶液中有关离子浓度从大到小的顺序为 。
(3)H3PO2可将溶液中的银离子还原为银单质,若该反应的氧化产物的化学式为H3PO4 , 则氧化剂与还原剂的物质的量之比为 。
Ⅱ.无机化合物A主要用于有机合成和药物制造,是具有良好前景的储氢材料。A中含有金属Li元素,遇水强烈水解,对化合物A加强热则其会发生分解反应(非氧化还原反应),生成化合物E和气体C。在一定条件下,2.30g固体A与5.35gNH4Cl固体恰好完全反应,生成固体B和4.48L气体C (标准状况)。已知气体C极易溶于水得到碱性溶液, 电解无水B可生成金属单质D和氯气。请回答下列问题:
(1)A的化学式是 ,C的电子式是 。
(2)写出化合物A与足量盐酸反应的化学方程式: 。
(3)物质A在加强热分解的化学方程式为: 。
(1)已知在氨水中存在下列平衡: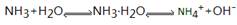
①向氨水中加入NaOH固体时,平衡向 (填“正反应”“逆反应”或“不”)移动,OH-的浓度 (填“减小”“增大”或“不变”)
②向氨水中加入浓盐酸,平衡向 (填“正反应”“逆反应”或“不”)移动,此时溶液中浓度增大的离子有NH4+(Cl-除外)和
(2)已知某溶液中只存在OH−、H+、NH4+、Cl−四种离子,某同学推测其离子浓度大小顺序有以下几种:
A.c(Cl−)>c(NH4+)>c(H+)>c(OH−) B.c(Cl−)>c(NH4+)>c(OH−)>c(H+)
C.c(NH4+)>c(Cl−)>c(OH−)>c(H+) D.c(Cl−)>c(H+)>c(NH4+)>c(OH−)
①上述关系一定不正确的是______(填序号).
②若溶液中只有一种溶质,则该溶液中离子浓度的大小关系为______(填序号).
③若四种离子浓度关系有c(NH4+)=c(Cl−),则该溶液显______(填“酸性”、“碱性”或“中性”).
(3)常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和NaNO3溶液中的一种。已知A、B的水溶液中水的电离程度相同,A、C溶液的pH相同。
①则:B是______溶液,C是______.
②常温下若B溶液中c(OH-)与C溶液中的c(H+)相同,B溶液的pH用pHb表示,C溶液的pH用pHc表示.则pHb+pHc= (填某个数)
答案:(1)①逆反应 增大 ②正反应 H+ (2)促进 不变
(3)①B ②A ③中性 (4)①CH3COONa 盐酸 ②14
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种,请回答后面问题:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)上述关系一定不正确的是 (填序号)。
(2)若溶液中只有一种溶质,则该溶质为 ,该溶液中离子浓度的大小关系为 (填序号)。
(3)若关系③正确,则溶液中溶质为 。
(4)若四种离子浓度关系有c(NH4+)=c(Cl-),则该溶液显 (填“酸性”、“碱性”、“中性”)。
(5)25℃,pH=a的盐酸VamL与pH=14-a的氨水VbmL混合,若溶液显中性,则Va Vb(填>、<、=、无法确定)。
试题篮
()