常温下有浓度均为0.5 mol/L的四种溶液:
①Na2CO3溶液 ②NaHCO3溶液 ③HCl溶液 ④氨水
(1)上述溶液中,可发生水解的是_______ _(填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为__________。
(3)向④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值_______(填“增大”、“减小”或“不变”)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是________________。
(5)取10 mL溶液③,然后加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=________ 。
氮元素可以形成多种氢化物,如NH3、N2H4等。
(1)据报道,2016年中国将发射“天宫二号”空间实验室,并发射“神舟十一号”载人飞船和“天舟一号”货运飞船,与“天宫二号”交会对接。火箭升空需要高能燃料,通常用肼(N2H4)作燃料,N2O4作氧化剂。已知
N2(g)+O2(g)=2NO(g)△H=+180.7kJ•mol-1
2NO(g)+O2(g)=2NO2(g)△H=-113.0kJ•mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol-1
2NO2(g) N2O4(g)△H=-52.7kJ•mol-1
N2O4(g)△H=-52.7kJ•mol-1
写出气态肼在气态四氧化二氮中燃烧生成氨气和气态水的热化学方程式:______________.
(2)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g),该反应的平衡常数和温度关系如下所示:
CO(NH2)2(l)+H2O(g),该反应的平衡常数和温度关系如下所示:
| T/℃ |
165 |
175 |
185 |
195 |
| K |
111.9 |
74.1 |
50.6 |
34.8 |
①该反应的△H 0(填“>”或“<”)。
②已知原料气中的氨碳比 为x,CO2的平衡转化率为a,在一定温度和压强下,a与x的关系如下图所示。a随着x的增大而增大的原因是__________。图中A点处,NH3的平衡转化率为__________。
为x,CO2的平衡转化率为a,在一定温度和压强下,a与x的关系如下图所示。a随着x的增大而增大的原因是__________。图中A点处,NH3的平衡转化率为__________。
(3)①在氢水加水稀释的过程中,NH3·H2O的电离程度____(填“增大”、“减小”或“不变”,下同), 的值__________。
的值__________。
②室温下,amol/L的(NH4)2SO4溶液的pH=5,原因是__________________(用离子方程式表示),该反应的平衡常数为__________(用含a的数学表达式表示)。
肼(N2H4)是一种高能燃料,在工业生产中用途广泛。
(1)写出肼的电子式 ,1mol N2H4 中有 个极性共价键。
(2)NH3与NaClO反应可以得到肼,该反应的化学方程式为 。
(3)发射火箭时,肼(N2H4)为燃料,双氧水作氧化剂,两者反应生成氮气和气态水。
已知1.6g液态N2H4在上述反应中放出64.22kJ的热量,写出该反应的热化学方程式:_________。
(4)肼—空气燃料电池是一种碱性电池,该电池放电时负极反应式为 。
(5)肼性质与氨气相似,易溶于水,可发生如下电离过程:
I、N2H4+H2O N2H5++OH— II、N2H5++H2O
N2H5++OH— II、N2H5++H2O N2H62++OH—
N2H62++OH—
①常温下,某浓度N2H6C12溶液的pH为5,则该溶液中由水电离产生的c(OH—)= 。
②已知在相同条件下过程I的进行程度大于N2H5+ 的水解程度。常温下,若0.2 mol/L N2H4溶液与0.1 mol/L HCl溶液等体积混合,则溶液中N2H5+ 、N2H4·H2O、Cl—、OH—、H+粒子浓度由大到小的顺序为____________。
根据下列化合物:①H2SO4②CH3COOH③NaCl④NaOH,⑤NH4Cl,⑥NH3•H2O,⑦(NH4)2SO4⑧Na2C2O4⑨NH4HSO4,回答问题:
(1)⑧溶液中,盐水解的离子方程式________________________。
(2)已知水存在如下平衡:H2O+H2O H3O++OH-,现欲使平衡向左移动,且所得溶液显酸性,可加入的试剂是上述中的__________。
H3O++OH-,现欲使平衡向左移动,且所得溶液显酸性,可加入的试剂是上述中的__________。
(3)浓度均为0.1mol∙L-1的③⑤溶液比较:c(Na+)__________c(NH4+)。浓度均为0.1mol∙L-1的③⑤溶液等体积混合后,c(Na+)+c(NH4+)+c(NH3∙H2O)=__________。
(4)物质的量浓度相同的①②③④⑤⑥六种稀溶液,按pH由大到小的顺序为(填序号)________。
(5)pH相同的⑤、⑦、⑨三种稀溶液中,c(NH4+)的顺序是(填序号)__________。
(6)pH均为4 ,等体积的①和②溶液分别加水稀释 n倍、m倍,稀释后两种溶液的 pH都变成 6,则 m________n(填 “<”、“>”或“=”)。
(7)常温下,使溶液⑤中,c(NH4+) =c(Cl-)的操作是_____________________。
食醋(主要成分CH3COOH)、纯碱(Na2CO3)和小苏打(NaHCO3)均为家庭厨房中常用的物质。已知:
| 弱酸 |
CH3COOH |
H2CO3 |
HNO2 |
| 电离常数 |
K=1.8×10-5 |
K=4.3×10-7 K=5.6×10-11 |
K=5.0×10-4 |
请回答下列问题:
(1)25℃时,0.10mol•L-1Na2CO3溶液的pH=11,则溶液中由水电离出的c(OH-)____________;
(2)常温下,将20mL 0.10mol•L-1CH3COOH溶液和20mL 0.10mol•L-1HNO2溶液分别与20mL 0.10mol•L-1NaHCO3溶液混合(混合后溶液体积变化忽略不计)。
①反应开始时,v(CH3COOH )______ v(HNO2)(填“>”、“<”或“:”),原因是____________;
②充分反应后.两溶液中c(CH3COO-)______ c(NO2-)(填“>”、“<”或“=”)。
(3)25°C时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中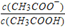 =_____;
=_____;
(4)常温下,下列方法可以使0.1mol·L-1CH3COOH的电离程度增大的是
a.加入少量的稀盐酸 b.加热溶液 c.加水稀释 d.加入少量冰醋酸
(5)PbSO4难溶于水却可溶于醋酸,你认为可能的原因是________。
①因醋酸是弱酸,故反应可进行 ②醋酸铅是弱电解质 ③醋酸铅在水中形成电离平衡时的c(Pb2+)小于PbSO4的溶解平衡的c(Pb2+)
电解质水溶液中可存在电离平衡,水解平衡,溶解平衡,依据所学回答下列问题。
(1)等物质的量浓度的下列四种溶液:①NH3·H2O ②(NH4)2SO3③KHSO3④K2SO3溶液中水的电离程度由大到小的排列顺序为________________(填序号)。
(2)体积相同、c(H+)相同的三种酸溶液①CH3COOH;②HCl;③H2SO4分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是(填序号) _____________。将c(H+)相同的三种酸均加水稀释至原来的10倍,c(H+)由大到小的顺序为_____________(填序号)。
(3)已知,H+ (aq) + OH-(aq) ="=" H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为____________。
(4)25℃时,NH3·H2O的电离常数为Kb=1.7×10-3。0.1mol·L-1NH4Cl溶液的pH=a,则c(NH4+)∶c(NH3·H2O)=_________(用含a的代数式表示)
(5)某化学研究性学习小组对电解质溶液作如下归纳总结(均在常温下),其中正确的有( )
①pH=1的强酸溶液,加水稀释后,溶液中各离子浓度一定都降低
②pH=2的盐酸与pH=13的NaOH溶液,按体积比9:1混合后的溶液pH为11
③pH相等的三种溶液:a.CH3COONa;b.NaHCO3;c.NaOH.其溶液物质的量浓度由小到大顺序为c、b、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42﹣)
⑤亚磷酸(H3PO3)是二元弱酸,所以Na2HPO3稀溶液一定呈碱性
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7.
⑦某二元酸在水中的电离方程式是H2B═H++HB﹣;HB﹣ H++B2﹣,则0.1mol/L的Na2B溶液中,c(Na+)=2c(B2﹣)+2c(HB﹣)
H++B2﹣,则0.1mol/L的Na2B溶液中,c(Na+)=2c(B2﹣)+2c(HB﹣)
(6)25℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,
Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33。在25℃下,向浓度均为0.1mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+刚好完全沉淀时,测定c(Al3+)=0.2mol·L-1。此时所得沉淀中________(填“还含有”或“不含有”)Al(OH)3。
(10分)已知H2SO3是二元弱酸,常温下现有0.1 mol/L H2SO3溶液,请回答以下问题:
(1)若向H2SO3溶液中加入少量NaHSO3固体,此时溶液中c(H+)/ c(HSO3-)________(填“增大”“减小”或“不变”)。
(2)若向H2SO3溶液中加入等浓度的NaOH溶液,且二者的体积比为2∶3,若反应后溶液可使紫色石蕊变红色,则所得溶液中物料守恒式为0.1 mol/L=______________,所得溶液中各离子的物质的量浓度由大到小的顺序是__________________。
(3)若向H2SO3溶液中加入NaOH溶液至溶液恰好呈中性,此时c(Na+)______2c(SO32-)(选填“>”、“<”或“=”)。
(4)若向H2SO3溶液中加入一定量NaOH溶液,所得混合液pH=6,则此溶液中
2c(SO32-) +c(HSO3-)-c(Na+)=________mol/L。
(1)CH3OH是一种可燃性的液体。
已知:① CH3OH (g)+H2O (l)=CO2 (g)+3H2 (g);△H= +93.0KJ·mol-1
② CH3OH (g)+1/2O2 (g)=CO2 (g)+2H2 (g);△H= -192.9KJ·mol-1
③ CH3OH (g)= CH3OH (l);△H= -38.19KJ·mol-1
则表示CH3OH的燃烧热的热化学方程式为
(2)燃料电池是符合绿色化学理念的新型发电装置,CH3OH—空气燃料电池是一种碱性(20%—30%的KOH溶液)燃料电池。电池放电时,负极的电极反应式为 。
(3)右图是一个电解过程示意图,假设使用CH3OH—空气燃料电池作为本过程中的电源,其中a为电解液,X和Y是两块电极板。
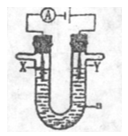
①若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电后,Y极板上发生的电极反应式为: 。
②若X、Y分别为石墨和铜,a为CuSO4溶液,铜片的质量变化128g,则 CH3OH一空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气体积分数为20%)
(4)已知高锰酸钾能氧化甲醇,也能氧化草酸。查阅资料,乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸。
①请配平该反应的离子方程式:
______MnO4-+______H2C2O4+______===____Mn2++______CO2↑+______。
②某兴趣小组同学将2.52 g草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,形成的溶液中各离子的浓度由大到小的顺序为___________________(用离子符号表示)。
(14分)某工业原料主要成分是NH4Cl、FeCl3和AlCl3。利用此原料可以得到多种工业产品。分析下面流程,回答问题。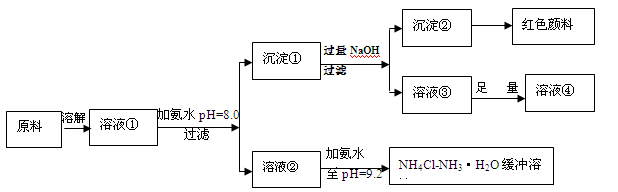
已知:Ksp[Fe(OH)3]=4.0×10-38
(1)用稀硫酸中和等体积等pH值的氨水和烧碱溶液,前者需要消耗的酸液体积 (填“大”“小”或“相同”)
(2)计算溶液②中Fe3+的物质的量浓度为 mol/L
(3)缓冲溶液中存在的平衡体系有: 、 、
此时溶液中c(NH4+) c(Cl-)(填>、=、<)。
(4)在缓冲溶液中加入少量盐酸或者NaOH溶液,溶液的pH值几乎依然为9.2。简述原理:
请举出另一种缓冲溶液的例子(写化学式) 。
(5)常温下向较浓的溶液④中不断通入HCl气体,可析出大量AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因: 。
常温下,将0.01molNH4Cl和0.002molNaOH溶于水配成1L溶液,
(1)该溶液中存在的三个平衡体系是________________ 、
______________ ______、_____________________________。
(分别用化学用语表示,下同)
(2)溶液中共有 种不同的粒子。
(3)这些粒子中浓度为0.01mol/L的是 ,浓度为0.002mol/L的是 。
(4)物质的量之和为0.01mol的二种粒子是__________________________。
(5) 和 两种粒子数量之和比OH-多0.008mol
(Ⅰ)水的电离平衡曲线如下图所示。
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)将100℃下的pH=8的Ba(OH)2溶液与100℃下的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为 。 (Ⅱ)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
(Ⅱ)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
| A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| B.c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| D.c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
(3)若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
(4)若上述关系中C是正确的,则溶液中溶质的化学式是 。
(5)若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl) c(NH3·H2O)(填“>”、“<”、或“=”,下同),混合后溶液中c(NH4+)与c(Cl-)的关系是c(NH4+) c(Cl-)。
(1)25℃时,浓度为0.1 mol•L-1的6种溶液①HCl ②CH3COOH ③Ba(OH)2④Na2CO3⑤KCl ⑥NH4Cl溶液pH由小到大的顺序为_________________(填写编号)。
(2)已知25℃时,CH3COOH电离常数Ka=1.7×10-5mol/L,则:
①该温度下CH3COONa的水解平衡常数Kh=__________ mol•L-1(保留到小数点后一位);
②将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3•H2O的电离常数Ka=____,混合后溶液中离子的浓度由大到小的顺序为__________________。
(3)25℃时,将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中
c(CH3COO-)+c(CH3COOH)=_________;m与n的大小关系是m___________n(填“>”“=”或“<”)。
室温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验 编号 |
HA的物质的量 浓度(mol/L) |
NaOH的物质的 量浓度(mol/L) |
混合后 溶液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=8 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?
(2)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)=___________mol/L。
(10分)神舟十号飞船是中国“神舟”号系列飞船之一,它是中国第五艘搭载太空人的飞船。神舟十号飞船发射成功后,将与2011年发射升空的天宫一号目标飞行器进行交会对接,开展相关空间科学试验。火箭推进器是成功发射的重要因素,事实上,推进器的发展经历了一个漫长的过程。
(1)20世纪前,黑火药是世界上唯一的火箭推进剂,黑火药是由硝酸钾、硫磺、木炭组成,黑火药爆炸的化学方程式为:S+3C+2KNO3=K2S+N2↑+3CO2↑。
①K2S的电子式为 。
②取黑火药爆炸后的残留固体,加水溶解过滤,得到滤液。写出检验此溶液中是否含有K+的实验操作方法 。
(2)20世纪60年代,火箭使用的是液体推进剂,常用的氧化剂有四氧化二氮、液氧等,可燃物有肼(N2H4)、液氢等。
①肼(N2 H4)溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式: 。
②一种与N2 H4电子数相等的绿色氧化剂,能将油画表面黑色的PbS氧化成白色的PbSO4,使油画变白、翻新,化学方程式为: 。
(3)以上的火箭推进剂一般含有氮元素,含氮化合物种类丰富。有一含氮化合物,具有很强的爆炸性,86g该化合物爆炸分解会生成标况下N267. 2L和另一种气体单质H2。写出其爆炸的化学方程式 。
(12分)乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,在100℃开始升华,157℃时开始分解。
(1)探究草酸的酸性
①已知:25℃ H2C2O4 K1=5.4×10-2,K2=5.4×10-5;H2CO3 K1=4.5×10-7 K2= 4.7×10-11
下列化学方程式正确的是
A.H2C2O4+CO32-= HCO3-+HC2O4- B.HC2O4-+CO32-= HCO3-+C2O42-
C.H2C2O4+CO32-= C2O42-+H2O+CO2 D.2C2O42-+CO2+H2O = 2HC2O4-+CO32-
②向1L 0.02mol/L H2C2O4溶液中滴加1L 0.01mol/L NaOH溶液。混合溶液中c(H+)>c(OH-),下列说法中正确的是 。
A.c(H2C2O4)>c(HC2O4-)
B.c(Na+)+c(H+)="2" c(C2O42-)+ c(HC2O4-)+c(OH-)
C.c(OH-)= c(H+)+2c(H2C2O4)+c(HC2O4-)
D.c(H2C2O4)+c(C2O42-)+c(HC2O4-)=0.02mol/L
(2)用酸性KMnO4溶液滴定Na2C2O4求算Na2C2O4的纯度。
实验步骤:准确称取1gNa2C2O4固体,配成100mL溶液,取出20.00mL于锥形瓶中。再向瓶中加入足量稀H2SO4 ,用0.016mol/L高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。
①高锰酸钾溶液应装在 滴定管中。(填“酸式”或“碱式”)
②滴定至终点时的实验现象是: 。
③下列操作可能使测量结果偏高的是
A.盛装的Na2C2O4的滴定管没润洗
B.盛装高锰酸钾溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
C.读数时滴定前仰视,滴定后俯视
D.锥形瓶中残留少量水
④计算Na2C2O4的纯度
试题篮
()