某些非金属单质可以与强碱溶液发生反应。例如白磷(P4)可以与过量的热NaOH溶液反应生成PH3气体和NaH2PO2(次磷酸钠)。
(1)上述反应的化学方程式为 。
(2)已知NaH2PO2水溶液pH>7,次磷酸是 元(填“一”、“二”或“三”) (填“强”或“弱”)。次磷酸的电离方程式为: ;NaH2PO2水溶液pH>7的原因: 。
(3)25℃时,向100mL0.01mol∙L-1的H3PO2溶液中,滴加等浓度的NaOH溶液至溶液呈中性,消耗NaOH溶液的体积 (填“>”、“=”或“<”)100ml。此时溶液中离子浓度由大到小的顺序是 。
硫和氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措。
(1)研究发现利用NH3可消除硝酸尾气中的NO污染。NH3与NO的物质的量之比分别为1﹕3、3﹕1、4﹕1时,NO脱除率随温度变化的曲线如图所示:
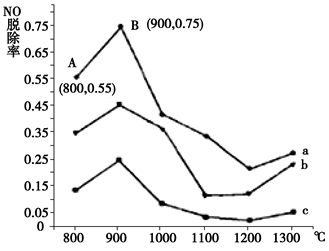
①用化学反应方程式表示NH3消除NO的反应原理 (不用注明反应条件)。
②曲线b 对应NH3与NO的物质的量之比是 。
③曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8 s,该时间段内NO的脱除速率为____ mg/(m3·s)。
(2)NO、NO2混合气体能被NaOH溶液吸收生成NaNO2和NaNO3,若吸收的溶液中N的浓度为ag·L- 1,要使1m3该溶液中的完全转化为,至少需通入标准状况下的O2 L。(用含a的代数式表示,计算结果保留整数)
(3)SO2被少许NaOH溶液吸收生成能使pH试纸变红的NaHSO3溶液,工业上可电解NaHSO3得到重要化工产品Na2S2O4。
①NaHSO3溶液中离子浓度大小为 。
②写出生成S2的电极反应式 。
(1)有下列物质①Cu ②液态SO2 ③CH3COOH ④NaHCO3 ⑤H2O ⑥熔融NaCl ⑦BaSO4属于弱电解质的是________________(填序号);
(2)常温下,0.1 mol•L-1NaHCO3溶液的pH大于8,则溶液中的Na+、HCO3-、CO32-、OH-四种微粒的浓度由大到小的顺序为:________________;NaHCO3水解的离子方程式为_____________;
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HA物质的量浓度(mol•L-1) |
NaOH物质的量浓度(mol•L-1) |
混合溶液的pH |
| a |
0.1 |
0.1 |
pH=9 |
| b |
c |
0.2 |
pH=7 |
请回答:
①从a组情况分析,HA是强酸还是弱酸____________;
②b组情况表明,c_____0.2 (选填“>”、“<”或“=”).混合溶液中离子浓度c(A-)_________c(Na+);(选填“>”、“<”或“=”)
③a组实验所得混合溶液中由水电离出的c(OH-)=_______mol•L-1。
工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Clˉ和SO42ˉ等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠的工艺流程图如下:
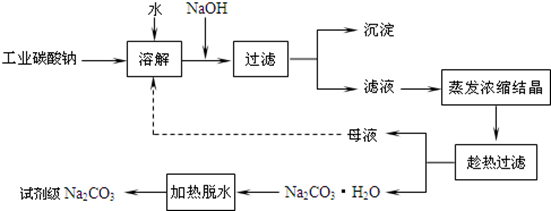
已知:碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
(1)加入NaOH溶液时发生的离子反应方程式为 、 。
(2)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释) 。
(3)“趁热过滤”时的温度应控制在 。
(4)已知:Na2CO3·10 H2O(s)=Na2CO3(s)+10 H2O(g) △H=+532.36kJ·mol—1
Na2CO3·10 H2O(s)=Na2CO3·H2O(s)+9 H2O(g) △H=+473.63kJ·mol—1
写出Na2CO3·H2O脱水反应的热化学方程式 。
(5)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用。请你分析实际生产中是否可行 ,其理由是 。
(7分)醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐。
(1)醋酸钠溶液中各离子浓度由大到小的顺序为 。
(2)对于醋酸溶液和醋酸钠溶液的下列说法正确的是 (填字母,下同)。
| A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小 |
| B.升高温度可以促进醋酸电离,而升高温度会抑制醋酸钠水解 |
| C.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离 |
| D.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离 |
(3)物质的量浓度均为 0.1 mol/L 的 CH3COONa 溶液和 CH3COOH 溶液等体积混合(混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是 。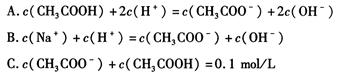
已知25 ℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
HSCN |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数 |
1.3×10—1 |
1.8×10—5 |
4.9×10—10 |
K1=4.3×10—7 K2=5.6×10—11 |
(1)同温度下,等pH值的a.NaHCO3 b.NaCN c.Na2CO3溶液的物质的量浓度由大到小的顺序为_____________(填序号)。
(2)25℃时,将20mL 0.1mol·L-1 CH3COOH溶液和20mL 0.1mol·L-1 HSCN溶液分别与20mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:

反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:_______________。反应结束后所得两溶液中,c(SCN—) c(CH3COO—)(填“>”、“<”或“=”)
(3)若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是________(填序号)
a.c(CH3COO-) b.c(H+) c.KW d.醋酸电离平衡常数
(1)25℃时,浓度为0.1mol•L-1的6种溶液,①HCl ②CH3COOH ③Ba(OH)2 ④Na2CO3 ⑤KCl ⑥NH4Cl溶液pH由小到大的顺序为_____________(填写编号);
(2)25℃时,醋酸的电离常数Ka=1.7×10-5 mol•L-1,则该温度下CH3COONa的水解平衡常数Kh="_____" mol•L-1 (保留到小数点后一位)
(3)25℃时,pH=3的醋酸和pH=11的NaOH溶液等体积混合,溶液呈_________(“酸性”、“中性”、“碱性”),请写出溶液中的电荷守恒式:_______________。
氮和硫的化合物对大气都有严重污染,据所学化学反应原理回答下列问题:
(1)NO2与悬浮在大气中海盐粒子的相互作用时发生反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) ∆H =" a" KJ/mol
NaNO3(s)+ClNO(g) ∆H =" a" KJ/mol
则该反应为 反应(填放热或吸热),产物ClNO的结构式为 。
(2)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为 (已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数K a=1.7×10-5mol/L,可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)若将SO2,NO2,O2按4:4:3通入水中充分反应,写出总的离子方程式 。
(4)向氨水中通入过量的H2S,所得溶液M中溶质的电子式为 ;取0.2mol/L的NaOH溶液与0.1mol/L的M溶液等体积混合,加热至充分反应后,待恢复至室温,剩余溶液中离子浓度由大到小的顺序是 ,此时测得溶液的pH=12,则此条件下M溶液中阴离子的电离平衡常数Ka= (提示:若涉及多元弱酸的电离或多元弱酸根离子的水解,均只考虑第一步电离或水解)
有X、Y、Z、W四种物质的水溶液,它们分别是Na2CO3、NaOH、CH3COOH和NaCl中的一种。已知X、Y两溶液中水的电离程度相同,X、Z两溶液的pH相同,有回答下列问题:
(1)X是_______,Z是_______;
(2)Z、W两溶液中水的电离程度由大到小的顺序为 _______(用化学式表示);
(3)X、Y两溶液恰好完全反应后,溶液中各离子浓度由大到小的顺序是
Al2O3、Al(OH)3都是重要化工原料。根据要求回答问题:
Ⅰ、电解法制高品质Al(OH)3装置如下(中间用离子交换膜隔开):
4Na[Al(OH)4]+2H2O 4Al(OH)3↓+4NaOH+O2↑+2H2↑
4Al(OH)3↓+4NaOH+O2↑+2H2↑

(1)产物Al(OH)3在 区(填“阴极”或“阳极”)沉积;
(2)电解中转移2mol e—时,将制得__________mol的Al(OH)3。
Ⅱ、制取纳米Al2O3需要纯净的硫酸铝。现有0.05mol·L-1硫酸铝溶液,经检测,含有Fe2+、Fe3+。可按下述操作提纯:往溶液中加足量H2O2充分反应,再用试剂X调节溶液pH=3.5。(室温下,0.1mol·L-1的Fe2+、Al3+开始沉淀的pH分别为7.0和3.7,Fe3+完全沉淀的pH=3.2)
(3)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为_________m。
(4)检验硫酸铝溶液含有Fe3+时,所采用的试剂及现象是_____________________。
(5)往溶液中加入H2O2的作用是 (用离子方程式表示)。
(6)加入的X试剂(填选项编号)是 。
| A.CuO | B.Al(OH)3 | C.NaOH | D.NaHCO3 |
若调节后溶液的pH偏离3.5,可能带来的后果是__________________________。
(1)与明矾相似,硫酸铁也可用作净水剂,其原理为_________(用离子方程式表示)。
(2)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为___________________。
(3)已知:S2O32—有较强的还原性,实验室可用I-测定K2S2O8样品的纯度,反应方程式为S2O82—+2I-=2SO42—+I2①、I2+2S2O32-=2I-+S4O62—②。S2O82—、S4O62—、I2氧化性强弱顺序:__________。
(4)已知溶液中,还原性为HSO3—>I-,氧化性为IO3—>I2>SO42—。在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示。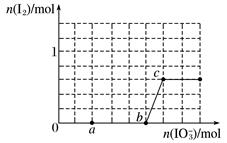
a点处的还原产物是__________(填离子符号);
b点→c点反应的离子方程式是__________________。
常温下,如果取0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液中由水电离出的c(H+)_______0.1mol/L NaOH溶液中由水电离出的c(H+) (填“>”、“<”或“=”)
(2)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断:NH4HCO3溶液的pH_______7(填“大于”、“小于”或“等于”);
(3)将同温度下等浓度的四种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
按pH由大到小的顺序排列是:__________________________(填序号)
(4) 求出混合液中下列算式的精确计算结果(填具体数字):
c(Na+)-c(A-)=_________mol/L,c(OH−)-c(HA)=_________mol/L
氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5 kJ,则该反应的热化学方程式为 。
(2)298 K时,在2 L固定体积的密闭容器中,发生可逆反应:
2NO2(g) N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
① 298k时,该反应的平衡常数为 L·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是 :
A.混合气体的密度保持不变;
B.混合气体的颜色不再变化;
C.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol,n(N2O4)="1.2" mol,则此时V(正) V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。
现向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序 。
③d、e点对应溶液中,水电离程度大小关系是d e(填“>”、“<”或“=”)。
(1)FeCl3的水溶液显________(“酸”、“中”、“碱”)性,原因是(用离子方程式表示):______;
(2)实验室配制FeCl3的溶液时,常将固体FeCl3先溶于_______中,然后再用蒸馏水稀释到所需的浓度。
(3)把FeCl3溶液蒸干、灼烧,最后得到的主要产物是____________
(4)普通泡沫灭火器内的玻璃筒里盛硫酸铝溶液,铁筒中盛碳酸氢钠溶液,其化学反应的原理是(用离子方程式解释)________________________________;
(5)Al2S3为什么不能用Na2S溶液和AlCl3溶液制备(用离子方程式解释)__________________;
现有25 ℃时,0.1 mol/L的氨水。请回答下列问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中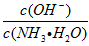 ________。(填“增大”、“减小”或“不变”)。
________。(填“增大”、“减小”或“不变”)。
(2)若向氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式:___________________;所得溶液的pH________7(填“<”、“>”或“=”),用离子方程式表示其原因_______________。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH)=a mol/L,则c(SO)=____________。
(4)若向氨水中加入pH=1的硫酸溶液,且氨水与硫酸溶液的体积比为1∶1,则所得溶液中各离子物质的量浓度由大到小的顺序是___________________________________。
试题篮
()