工业合成氨与制备HNO3一般可连续生产,其流程如下:
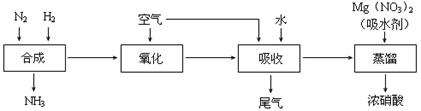
①写出工业合成氨的化学方程式 ,上述尾气中的NO2一定条件下可与氨气反应转化为氮气,则该反应的化学方程式为 。
②某同学在实验室蒸馏含有Mg(NO3)2的稀硝酸制取浓硝酸,除导管、酒精灯、牛角管、锥形瓶外,还需的玻璃仪器有 。
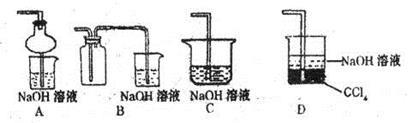
(2)某兴趣小组采用右图装置制取并探究SO2气体的性质。

①下列实验方案适用于右图所示装置制取所需SO2的是_________(填序号)
| A.Na2SO3溶液与HNO3 | B.Na2SO3固体与浓硫酸 |
| C.固体硫在纯氧中燃烧 | D.铜与浓H2SO4 |
②组装完仪器后,检查装置气密性的方法是:________
③若要证明c中生成的气体是SO2,d中加入品红溶液后,打开活塞b,反应开始,待d中溶液_____________后,再________________(填实验的操作)试管d中的溶液,颜色又恢复,证明气体是SO2。
④指导老师指出应增加一尾气吸收装置,并帮助同学们设计了如下装置,其中合理的是______________(填序号)。
(16分)纳米氧化铝在陶瓷、电子、生物医药等方面有广泛的用途,它可通过硫酸铝铵晶体热分解得到[已知:硫酸铝铵晶体的化学式为Al2(NH4)2(SO4)4·24H2O,相对分子质量为906].制备硫酸铝铵晶体的实验流程如下:
(1)H2O2氧化FeSO4的离子方程式为 .
(2)加入氨水的目的是 ,其化学反应方程式为 .
(3)若要保证产品的纯度,必须检验加入氨水后杂质是否除尽?其实验操作是:用试管取少量滤液, ,则说明杂质已除净.
(4)上述流程中,“分离”所包含的操作依次为: 、 、过滤、洗涤、干燥;请完成硫酸铝铵晶体高温分解的化学方程式:2Al2(NH4)2(SO4)4·24H2O Al2O3+ NH3↑+ SO3↑+ .
Al2O3+ NH3↑+ SO3↑+ .
(5)取4.53 g 硫酸铝铵晶体加热分解,最终剩余0.51 g Al2O3固体.加热过程中,固体质量随温度的变化如图所示.请计算确定400℃时(硫酸铵未分解)剩余固体成分的化学式为 (不必写出计算过程).
2014年德美科学家因开发超分辨荧光显微镜获诺贝尔化学奖,他们开创性的成就使光学显微镜分辨率步入了纳米时代。
Ⅰ.在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。下图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
(1)实验室若用NH4Cl和熟石灰作试剂来制取、收集干燥的NH3,请选择装置并按气流方向连接各仪器接口 (填装置接口顺序),若要制取、收集干燥的CO2,则需选用上述仪器装置中的 (填装置序号)。
(2)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是 。试写出制纳米级碳酸钙的离子方程式 。
Ⅱ.纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
(3)制备TiO2的常见方法:将TiCl4水解产物加热脱水生成TiO2。已知常温下Ti(OH)4的Ksp=7.94×10-54,测得TiCl4水解后溶液常温下的pH=2,则此时溶液中:c (Ti4+)= 。
(4)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。配制NH4Fe(SO4)2标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要右图中的_______(填字母代号)。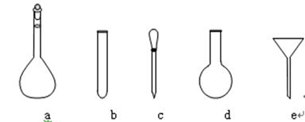
(5)滴定终点的现象是 。
(6)滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则试样中TiO2质量分数表达式为 。
Ⅲ.(7)纳米材料具有很多特殊的优良性能,其颗粒大小一般在1~100 nm之间。试设计简单的实验方案,判断Ⅰ、Ⅱ实验中所得样品颗粒是否为纳米级 。
(9分)(1)下图装置甲是某种不溶于水的气体X的发生装置和收集装置(必要时可以加热),所用的试剂从下列试剂中选取2-3种:硫化亚铁、二氧化锰、铜屑、氯化铵、稀氨水、大理石、浓硫酸、浓硝酸、稀硝酸、蒸馏水。
①气体X的分子式是 。
②所选择的药品a是 ,c是 。
③下列装置乙和丙,能代替装置甲的简易装置是 (填“乙”或“丙”)
④请写出在试管a中所发生反应的离子方程式 。
(2)在进行研究性学习的过程中,学生发现等质量的铜片分别与等体积均过量的浓硝酸或稀硝酸反应(假设反应前后溶液体积不变),所得到溶液前者呈绿色,后者呈蓝色,针对这种现象,学生进行了讨论,出现两种意见,一种认为:Cu2+浓度差异引起了这种现象,你认为 (填“正确”或“不正确”),依据是: ;
另一种意见是:溶液呈绿色可能是Cu2+与NO2混合的结果,并用实验进行了证明,这些方案中可行的是 ;
a.加热该绿色溶液,观察颜色变化b.加水稀释绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
(3)足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是 mL。
某化学学习小组发现在碱性溶液中,NO2会发生如下反应:
 2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
于是提出猜想,NO2和碱性的NaHCO3溶液也能发生类似反应。该小组利用如图所示装置,使NO2和NaHCO3溶液充分反应后,获得溶液X。

(1)Cu与浓硝酸反应的现象是_______________________。
(2)该小组同学为了对猜想进行探究,进行如下讨论和实验。
①甲同学认为,可通过检验X中是否存在NO3—的方法验证猜想。但经讨论后认为不可行,你认为其原因是 。
②乙同学在X中加入少量K2Cr2O7溶液,结果溶液褪色,则证明X中含有NaNO2。根据以上信息,写出NO2与NaHCO3溶液反应的离子方程式_________________ 。
(3)已知在酸性条件下NO2— 能将I— 氧化为I2。你认为能否用KI淀粉溶液检验X中存在NaNO2: ___________(填“能”或“不能”),原因是____________________________。
(4)已知5NO2— + 2MnO4—+6H+= 5NO3—+ 2Mn2+ +3H2O。称取a g KMnO4固体,加蒸馏水和少量稀硫酸溶解,配成250 mL溶液。移取20.00mL X于锥形瓶,用所配的酸性KMnO4溶液进行滴定,消耗b mL KMnO4溶液。滴点终点的现象是 ,则X中NaNO2的浓度是______________(用含a、b的式子表示)。
(11分)三颈瓶在化学实验中的应用非常广泛,下面是三颈瓶在部分无机实验或有机实验中的一些应用。
(1)在如图所示装置中,进行氨的催化氧化实验:向三颈瓶内的浓氨水中不断通入空气,将红热的铂丝插入瓶子并接近液面。反应过程中可观察到瓶中有红棕色气体产生,铂丝始终保持红热。实验过程中 的电离程度____(填“变大”、“变小”或“不变”)
的电离程度____(填“变大”、“变小”或“不变”)
(2)实验室用下图所示装置制备氨基甲酸铵( ),其反应化学方程式:2NH3(g)+CO2(g)
),其反应化学方程式:2NH3(g)+CO2(g)  NH2COONH4(s)该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
NH2COONH4(s)该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
①写出加入药品之前实验操作的要点_______;反应中若有水存在则生成碳酸氢铵的化学方程式是________________________。
②干燥管中盛放的药品是______。简述左侧三颈瓶装置制取氨气的原理________。
③对比碳酸盐和酸的反应制取CO2,该实验利用干冰升华产生气体CO2的有优点有_____.
④有同学认为该实验装置存在安全问题,请问可能面临的安全问题是________。
⑤氨基甲酸氨可用作肥料,其肥效比尿素[CO(NH2)2] _______(填“高”或“低”),在潮湿的空气中释放出氨而变成碳酸氢铵。取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7830g,用足量石灰水充分处理后,使样品中碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g,则样品中氨基甲酸铵的物质的量分数是_____________。
半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5,PCl3遇水会强烈水解生成 H3PO3和HCl。遇O2会生成POCl3,POCl3溶于PCl3,PCl3、POCl3的熔沸点见下表:
| 物质 |
熔点/℃ |
沸点/℃ |
| PCl3 |
-112 |
75.5 |
| POCl3 |
2 |
105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为 。
(2)B中所装试剂是 ,E中冷水的作用是 F中碱石灰的作用是_____。
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用 。
(4)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后.通过_____(填实验操作名称),即可得到较纯净的PCl3。
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00mL,向其中加入10.00 mL 0.1000 mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3,溶液滴定
④重复②、③操作,平均消耗Na2S2O3,溶液8.40ml
已知:H3PO3+H2O+I2=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,假设测定过程中没有其他反应。根据上述数据,该产品中PC13的质量分数为_______。
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g)+CO2(g) NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用下图装置制取氨气,你所选择的试剂是 。
(2)制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是: 、 。
液体石蜡鼓泡瓶的作用是: 。
②从反应后的混合物中分离出产品,为了得到干燥产品,应采取的方法是______ (填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.真空40 ℃以下烘干
③尾气处理装置如图所示。
双通玻璃管的作用: ;
浓硫酸的作用: 、 。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品11.73 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为15.00 g。则样品中氨基甲酸铵的物质的量分数为 。
NH3及其盐都是重要的化工原料。
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为 、 、 (填字母)。

(2)恒定温度下在特制的密闭真空容器中充入2molNH3、1molCO2,发生反应制备氨基甲酸铵 2NH3(g)+CO2(g)  NH2COONH4(s)(假设固体试样体积忽略不计)。若容器体积不变,可以判断该反应已经达到化学平衡的是 (填字母)。
NH2COONH4(s)(假设固体试样体积忽略不计)。若容器体积不变,可以判断该反应已经达到化学平衡的是 (填字母)。
A.υ(NH3)= 2υ(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
上述反应达到平衡后,若在恒温下压缩容器体积,重新达平衡后混合气体中NH3的体积分数 (填“增加”、“减小”或“不变”)。
(3)铵盐在水溶液中建立如下水解平衡:NH4Cl+H2O NH3·H2O+HCl,研究表明,浓度、温度、pH均对铵盐水解程度(即上述反应中中NH4Cl的转化率)产生影响。某兴趣小组探究某一种因素对溶液中NH4Cl水解程度的影响。
NH3·H2O+HCl,研究表明,浓度、温度、pH均对铵盐水解程度(即上述反应中中NH4Cl的转化率)产生影响。某兴趣小组探究某一种因素对溶液中NH4Cl水解程度的影响。
试剂与仪器:固体NH4Cl、蒸馏水、100mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、pH计、温度计、恒温水浴槽(可控制温度)。
设计实验方案,pH为拟测定的数据,表中V(溶液)表示所配制NH4Cl溶液的体积。
| 物理量 实验序号 |
V(溶液)/mL |
NH4Cl /g |
温度/℃ |
pH |
… |
| 1 |
100 |
m |
T1 |
|
… |
| 2 |
100 |
m |
T2 |
|
… |
| 3 |
100 |
2m |
T2 |
|
… |
请分析,实验1、2的目的是探究 对溶液中NH4Cl水解程度的影响,实验2、3的目的是探究 对溶液中NH4Cl水解程度的影响。
为了证明稀硝酸与铜反应的气体产物是NO,某同学设计了如下实验装置和实验方案。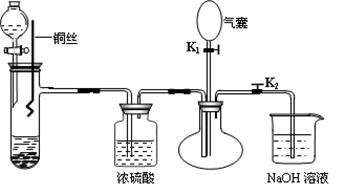
实验步骤:
(1)关闭K1,打开K2,向试管中加石灰石,通过分液漏斗向其中加入一定的稀硝酸,则加入石灰石的作用是________________________________,反应化学方程式是 。
(2)将将铜丝插入稀硝酸中,微热大试管。该步反应离子方程式是 。
(3)充分反应后,打开开关K1,通过气囊鼓入空气,可以观察到烧瓶中 ,证明稀硝酸与铜反应的气体产物是NO。
(4)NaOH溶液的作用 。
NH3和HNO3是重要的工业产品,下图是合成氨和氨氧化制硝酸的工艺流程。
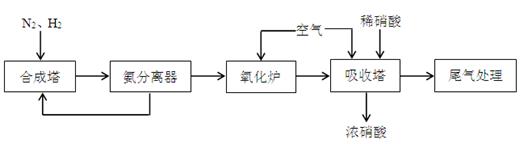
(1)合成塔中发生反应的化学方程式是 。
(2)氨分离器中压强约为15MPa,温度约为-20℃,分离氨应用了氨 的性质,从氨分离器中又回到合成塔中的物质是 。
(3)氧化炉中反生反应的化学方程式是 。
(4)尾气中的少量NO、NO2可以用NH3来处理,在催化剂作用下生成无污染的气体,写出NO2和NH3反应的化学方程式 。当有5.6LNO2被还原时,转移电子的物质的量为 mol。
(5)氧化炉中出来的气体,先降温再进入吸收塔,吸收塔中通入空气的作用是 。若进入吸收塔的气体的体积分数为NO210.0%,NO 1.32%,其余为N2、水蒸气等。当进入氧化炉中气体为10m3时,最少需要空气的体积为 m3。
I实验室用加热固体氯化铵和氢氧化钙的混合物制取氨,反应的化学方程式为: 。所制得气体中常含有少量杂质气体,为了得到纯净的氨气并加以检验,请在下列装置或试剂中,根据要求作出适当选择,并将编号字母填入表中的空格处。
(1)装置:
(2)试剂: a.NaOH溶液 b.澄清石灰水 c.浓硫酸 d.饱和NaHCO3溶液 e.碱石灰f.品红溶液 g.湿润的红色石蕊试纸
| 制取 气体 |
杂质气体 |
制取气体的 发生装置 |
除去杂质气体的净化装置 |
收集 装置 |
净化装置内 所用试剂 |
检验制得气 体所用试剂 |
| NH3 |
H2O(g) |
|
|
|
|
|
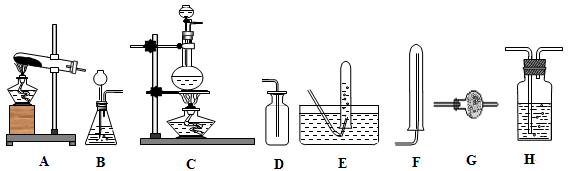
II如图所示,在干燥的圆底烧瓶里充满氨气,用带有玻璃管和滴管(滴管里预先吸入水)的塞子塞紧瓶口。立即倒置烧瓶,使玻璃管插入盛有水的烧杯里(预先在水里滴入少量酚酞溶液)。打开橡皮管上的夹子,轻轻挤压滴管,使少量水进入烧瓶,可观察到的现象为:____ 。
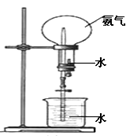
肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。
CO(NH2)+2NaOH+NaClO═Na2CO3+N2H4•H2O+NaCl
NaClO过量时,易发生N2H4•H2O+2NaClO═N2↑+2NaCl+3H2O
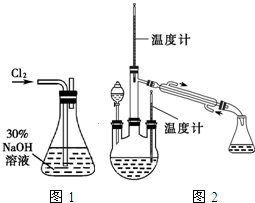
实验一:制备NaClO溶液.(实验装置如图1所示)
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有______________(填标号);
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)锥形瓶中发生反应的化学方程式是______________;
实验二:制取水合肼.(实验装置如图2所示)
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应.加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。
(已知:N2H4•H2O+2NaClO═N2↑+3H2O+2NaCl)
(3)分液漏斗中的溶液是_______(填标号);
A.CO(NH2)2溶液
B.NaOH和NaClO混合溶液
选择的理由是______________;
实验三:测定馏分中肼含量
称取馏分5.000g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL,用0.1000mol•L-1的I2溶液滴定.滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4•H2O+2I2═N2↑+4HI+H2O)
(4)滴定过程中,NaHCO3能控制溶液的pH在6.5左右,用离子方程式解释其原因______________;
(5)实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4•H2O)的质量分数为___________;
Ⅰ.乙组同学用下列装置来证明铜与稀硝酸反应产生一氧化氮,

B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
(1)实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的 。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为________________________。
(3)装置E中开始时出现浅红棕色气体,用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深,产生上述现象的原因是 。
(4)一段时间后,C中白色沉淀溶解,其原因是____________________。
(5)装置D的作用是________________________。
Ⅱ.已知向含有淀粉的10mL0.2mol/LKIO3酸性溶液滴滴加0.3mol•L-1NaHSO3溶液的过程中,溶液的颜色先变蓝然后褪色,发生的离子反应如下:
①______IO3-+______HSO3-=_______I2+_______SO42-+_______H2O+ ________
②I2+HSO3-+H2O═2I-+SO42-+3H+
回答下列问题
(1)配平离子反应方程式①
______IO3-+______HSO3-=_______I2+_______SO42-+_______H2O+ ________
(2)根据①②反应写出还原性粒子HSO3-、I2、I-由强到弱的顺序_________________;
(3)当溶液刚好褪色时,则消耗的NaHSO3溶液的体积为___________________;
(4)预测已知向含有淀粉的NaHSO3溶液滴加KIO3溶液的现象____________________
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g)+CO2(g) NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用下图装置制取氨气,你所选择的试剂是 。

(2)制备氨基甲酸铵的装置如上图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是: 、 。
液体石蜡鼓泡瓶的作用是: 。
②从反应后的混合物中分离出产品,为了得到干燥产品,应采取的方法是____ (填写选项序号)。a.常压加热烘干 b.高压加热烘干 c.真空40 ℃以下烘干
③尾气处理装置如图所示。
双通玻璃管的作用: ;浓硫酸的作用: 、 。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品11.73 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为15.00 g。
则样品中氨基甲酸铵的物质的量分数为 _____ 。
试题篮
()