某化学课外活动小组通过实验研究NO2的性质。
已知:2NO2+2NaOH=NaNO3+NaNO2+H2O
利用下图1所示装置探究NO2能否被NH3还原(K1,K2为止水夹.夹持固定装置略去)
(1)E装置中制取NO2反应的离子方程式是 。
(2)该实验中制取氨气时若只用一种试剂,从下列物质中选取 。
a.NH4HCO3 b.NH4Cl c.浓氨水
(3)若NO2能够被NH3还原,预期观察到C装置中的现象是 。
(4)实验过程中气密性良好,但未能观察到C装置中的预期现象。该小组同学分析其原因可能是:
①;还原性较弱,不能将NO2还原;②在此条件下,NO2的转化率极低;
③ 。
(5)此实验装置存在一个明显的缺陷是 。
(6)为了验证NO2能被Na2O2氧化,该小组同学选用B、D、E装置,将B中的药品更换为Na2O2。另选F装置(如图2所示),重新组装,进行实验。装置的合理连接顺序是____。实验过程中,B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中反应的化学方程式为________________________________。
为了证明铜与稀硝酸反应产生NO,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
(1) 实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的为 。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为 。
(3)装置E中开始时出现浅红棕色气体,用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深,产生上述现象的原因是 。
(4)一段时间后,C中白色沉淀溶解,其原因是________________________ __。
(5)装置D的作用是_________ ___________________________________。
为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是可控制气体流向,用于鼓入空气的双连打气球。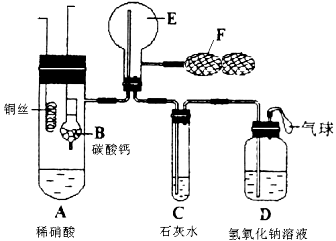
(1) 实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的为
__________________________________。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为______________________。
(3)装置E中开始时出现浅红棕色,原因是__________________________;用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深,产生上述现象的原因是__________________________________。
(4)一段时间后,C中白色沉淀溶解,其原因是_________________________________;
。(用化学方程式表示)
(5)装置D的作用是_____________________________________________________。
盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列问题:
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有 性。用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有 性。
(2)硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。下列制备方法符合“绿色化学”思想的是 (填序号)。
① Cu + HNO3(浓)→ Cu(NO3)2 ② Cu + HNO3(稀)→ Cu(NO3)2
③ Cu CuO
CuO Cu(NO3)2
Cu(NO3)2
(3)①在100mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,测得产生的气体在标准状况下的体积可能是 。
| A.40.32L | B.30.24L | C.20.16L | D.13.44L |
②若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式_______________________________________________________________________。
(4)若将12.8g铜跟一定质量的浓HNO3反应,铜消耗完时,共产生气体5.6L(标准状况),则所耗HNO3的物质的量 mol。
(5)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反应的化学方程式为 。
已知硝酸铜溶液呈蓝色。但在铜与浓硝酸、稀硝酸反应的实验中,同学们发现,除了生成的气体颜色不相同外,最终溶液的颜色也不相同:前者呈绿色,而后者呈蓝色。甲、乙二位同学为此进行了实验探究。
甲:在I、II两支试管中分别加入等体积的浓HNO3和稀HNO3,再向两支试管中分别投入等质量的铜片,充分反应后铜均无剩余。结果:I中溶液呈绿色,II中溶液呈蓝色。
乙:分别取I中的绿色溶液于两支试管Ⅲ、IV中,对试管Ⅲ进行多次振荡、静置,最终溶液颜色由绿色转变为深蓝色;向试管IV中缓缓加水并不停振荡,观察到溶液由绿色变为深蓝色,最后变为淡蓝色。
请回答下列问题:
(1)分别写出Cu与浓HNO3、稀HNO3反应的化学方程式:__________、__________。
(2)甲的实验_______(“能”或“不能”)说明溶液呈现不同的颜色与其物质的量浓度无关,这是因为充分反应后,I、II两试管中Cu(NO3)2溶液的物质的量浓度_______(填“相等”或“不相等”)。
(3)请你根据乙的实验,推测Cu与浓HNO3反应后溶液呈绿色的原因是________
_______________________________________________________________。
(4)请设计一个方案,验证你所得到的上述结论:____________________________
____________________________________________________________________。
某化学课外活动小组设计实验探究氨气的化学性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取: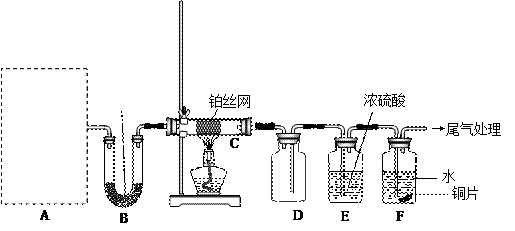
a. NH4HCO3 b. NH4Cl c. Ca(OH)2 d. NaOH 检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯。部分实验现象如下:铂丝继续保持红热,F处铜片逐渐溶解。
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯。部分实验现象如下:铂丝继续保持红热,F处铜片逐渐溶解。
(1)实验室制取A中气体时若只用一种试剂,该试剂是_______(填代表备选试剂的字母);此时A中反应的化学方程式_______ ,A中主要的玻璃仪器有_______(填名称)。
(2)C中发生反应的化学方程式为_______,该反应是_________反应(填“吸热”或“放热”)。
(3)浓硫酸的作用____________________;铜片溶解的化学方程式_________________.
(4)待实验结束后,将B中固体混合物溶于500 mL 1 mol·L-1的盐酸中,产生无色混合气体甲,溶液呈中性,则实验前B中原有Na2O2的物质的量是_______ mol。
试题篮
()