已知A、B、C、D、E五种主族元素分别位于第1、2、3周期,原子序数依次增大,其中A与C、B与D分别同主族,且B原子的最外层电子数等于A与C原子序数之和的一半,下列叙述正确的是
A.原子半径:A<B<C<D<E
B.D、E的气态氢化物的热稳定性:D>E
C.A与B、C与B均能形成X2Y2型化合物,且其中所含有的化学键类型相同
D.另外四种元素能够分别与C形成含单原子核阴离子的离子化合物
四种元素A、B、C、D,其中A元素原子的原子核内只有一个质子;B的基态原子s能级的总电子数比p能级的总电子数多1;C元素的原子最外层电子数是次外层的3倍;D是形成化合物种类最多的元素。
(1)A、D形成的某种化合物甲是一种重要的化工产品,可用作水果和蔬菜的催熟剂,甲分子中σ键和π键数目之比为________;写出由甲制高聚物的反应方程式 。
(2)A、C形成的某种化合物乙分子中含非极性共价键,乙分子属于________(“极性分子”或“非极性分子”);其电子式________;将乙加入浅绿色氯化亚铜溶液中,溶液变为棕黄色,写出该反应的离子方程式______________。
(3)写出B的基态原子电子排布图为 。与PH3相比,BA3易液化的主要原因是_____________;
(4)笑气(B2C)是一种麻醉剂,有关理论认为B2C与DC2分子具有相似的结构。故B2C的空间构型是________,其为________(填“极性”或“非极性”)分子。
关于化学键的下列叙述中,正确的是
| A.离子化合物中可能含离子键 | B.共价化合物中可能含离子键 |
| C.离子化合物中不含共价键 | D.共价化合物中不含离子键 |
最近,科学家在甲烷的低温活化与二氧化碳加氢研究上取得了突破,其反应原理如下: 。下列说法错误的是
。下列说法错误的是
| A.CO2、CH3COOH均为共价化合物 |
| B.每生成1molCH3COOH,要消耗22.4LCO2 |
| C.CO2、CH3COOH分子中均含σ键和π键 |
D. 属于氧化反应 属于氧化反应 |
NA代表阿伏伽德罗常数。已知C2H4和C3H6的混合物的质量为ag,则该混合物
| A.所含共用电子对数目为(a/7+1)NA | B.所含碳氢键数目为aNA/7 |
| C.燃烧时消耗的O2一定是33.6a/14 L | D.所含原子总数为aNA/14 |
酚酞是中学阶段常用的酸碱指示剂,结构简式如图所示:下列关于酚酞的说法错误的是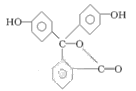
| A.酚酞与水可以形成氢键 |
| B.酚酞的分子式为C20H14O4 |
| C.酚酞结构中含有羟基(—OH),故酚酞属于醇 |
| D.酚酞在一定条件下能够发生加成反应 |
下列化学用语的书写,正确的是
A.氯原子的结构示意图: |
| B.6个质子8个中子的碳元素的核素符号:12C |
C.氯化镁的电子式: |
D.用电子式表示氯化氢的形成过程:  |
将下列晶体熔化:氢氧化钠、二氧化硅、氧化钙、四氯化碳,需要克服的微粒间的相互作用
①共价键 ②离子键 ③分子间作用力,正确的顺序是
| A.①②②③ | B.②①②③ | C.②③②① | D.①①②③ |
下图是常温下,部分短周期元素最高价氧化物对应水化物的等物质的量浓度稀溶液的pH值与原子序数的关系图,Z的氧化物是两性氧化物。下列说法正确的是
| A.L对应的氢化物比E对应的氢化物更稳定、熔沸点更高的原因是L的氢化物可以形成两种化学键 |
| B.W、R两种元素的最高价氧化物对应的水化物的pH后者较大 |
| C.元素E、W对应的单质,其晶体类型可能相同、也可能不同,这是由于它们形成晶体的化学键类型不同造成的 |
| D.元素X、Y、W形成的化合物溶液可能能与W的最高价氧化物反应,既生成沉淀,又产生气体 |
A~I都是由短周期元素组成的常见物质,它们之间的转化关系如下图所示。已知:A为气体,其水溶液呈碱性;D、F均能与人体血液中的血红蛋白结合而使人中毒;E可作为半导体材料。
(1)化合物A的电子式为_______________________。
氧化物I中化学键类型:_____________________。
组成E单质的元素在元素周期表中的位置是____________________________。
图中物质所含元素原子的半径由大到小依次是(写元素符号)_____________。
(2)反应④的化学方程式为______________________________________________。
(3)将F与B按体积比2:1混合生成气体M,常温下测定M相对分子质量时,得到的实验值总是比理论值偏大,其原因是(用化学方程式表示)___________________。
(4)某容积为V L的试管中充满F气体(标准状况下),若将该气体完全被水吸收,需通入B的物质的量为(写含V的表达式)_______________mol,此时所得溶液中再通入气体A,恰好完全反应后所得溶液中各离子浓度由大到小依次为:_________________________。
(13分)A、B、C、D、E是原子序数依次增大的五种短周期元素。A原子的电子层数与它的核外电子总数相同,A与C、B与 D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同,A与E形成的化合物化学式为AE,其分子中含18 个电子。请回答下列问题:
(1)A元素单质的化学式为 ,D元素的离子结构示意图为_ __。
(2)写出C、D、E最高价氧化物对应水化物的化学式 、 、 (用化学式表示)。
(3)由B元素形成的单质的结构式可表示为 ___。
(4)由A、B、C三种元素形成的化合物的电子式为 ___,这种化合物中所含的化学键类型有 。
(5)比较D、E的气态氢化物与HF的稳定性的由强到弱的顺序为 (用化学式表示)。
短周期主族元素X、Y、Z、W的原子序数依次增大,原子半径r(W)>r(Y)>r(Z)>r(X)。X与W同主族,Z原子最外层电子数是其内层电子总数的3倍,Z原子的核电荷数等于X、Y原子核电荷数之和。下列说法正确的是
| A.工业上常用电解的方法制备W的单质 |
| B.元素Z的简单气态氢化物的热稳定性比Y的强 |
| C.仅由X、Y、Z三种元素形成的化合物的水溶液一定呈碱性 |
| D.化合物X2Z2与W2Z2所含化学键类型完全相同 |
C60可用作储存氢气的材料,结构如图所示。继C60后,科学家又合成了Si60、N60,三种物质结构相似。下列有关说法正确的是
| A.C60、Si60、N60都属于原子晶体 |
| B.C60、Si60、N60分子内共用电子对数目相同 |
C.由于 键能小于 键能小于 ,故N60的稳定性弱于N2 ,故N60的稳定性弱于N2 |
D.由于 键长小于 键长小于 键,所以C60熔沸点低于Si60 键,所以C60熔沸点低于Si60 |
在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛。
(1)溴元素在周期表中的位置为 。
(2)下列说法中正确的是 。
| A.CCl4和XeF2分子中各原子最外层均满足8e-结构 |
| B.Cl2O5和Cl2O7都是酸性氧化物 |
| C.氟非金属性强于氯,故氢氟酸的酸性强于盐酸 |
| D.F-、Cl-、Br-、I-等离子的还原性逐渐增强 |
(3)已知:HCl的沸点是﹣85.0℃,HF的沸点是19.5℃。HF的电子式为 ;从HF、HCl混合气体中分离出HF的方法是 。
(4)向NaClO浓溶液中加入Al2(SO4)3浓溶液,迅速生成大量白色沉淀,同时有无色气体产生。生成白色沉淀的离子方程式为 。无色气体的成分为 。
(5)潮湿的氯气与碳酸钠粉末反应可用于制取氯的最低价氧化物,反应还同时生成两种盐,该反应的化学方程式为 。
(6)已知:还原性HSO3¯>I¯,氧化性IO3¯> I2,在下图中画出向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液的过程中,析出I2的物质的量与KIO3的物质的量之间关系的曲线。

试题篮
()