(Ⅰ)某钠盐溶液中通入足量氨气,无明显现象。再在所得溶液中通入过量CO2,产生大量白色沉淀。
(1)写出氨气的电子式 。
(2)该钠盐溶液中一定不可能含有下列哪种微粒 (填编号)。
| A.Cl- | B.Fe2+ | C.SiO32- | D.AlO2- |
(3)写出一个通入过量CO2时生成白色沉淀的离子方程式 。
(Ⅱ)电镀工业中往往产生大量的有毒废水,必须严格处理后才可以排放。某种高浓度有毒的含A离子(阴离子)废水在排放前的处理过程如下:
已知:9.0g沉淀D在氧气中灼烧后,产生8.0g黑色固体,生成的气体通过足量澄清石灰水时,产生10.0g白色沉淀,最后得到的混合气体除去氧气后,还剩余标况下密度为1.25g/L的气体1.12L。
(4)沉淀D的化学式是 。
(5)写出沉淀D在氧气中灼烧发生的化学方程式 。
(6)滤液C中还含有微量的A离子,通过反应②,可将其转化为对环境无害的物质,试用离子方程式表示该原理 。
(7)反应①为制得某种元素的低价X离子,试从氧化还原反应的角度分析,是否可以用Na2SO3溶液来代替B溶液 ,
并设计实验证明所用Na2SO3溶液是否变质 。
I.下列各组物质:
① 、
、 、
、 ②石墨和C60 ③水和冰
②石墨和C60 ③水和冰
④正戊烷和异戊烷 ⑤35Cl2、37Cl2
其中,
(1)属于同分异构体的是 (填序号,下同)
(2)属于同素异形体的是
(3)属于同位素的是
II.下列6种固态物质:①P4 ②SiO2 ③NH4Cl ④NAF ⑤CO2(干冰) ⑥金刚石,
回答下列问题:
(1)熔化时不需要破坏化学键的化合物是 (填序号,下同)
(2)熔化时需要破坏共价键的单质是
(3)含有共价键的离子化合物是
短周期A、B、C、D 4种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上电子数之和。
(1)A的原子结构示意图是___________ E的电子式为___________;
(2)D在周期表中的位置是 ______。它的下一周期同族元素最高价氧化物对应的水化物的分子式为___________;
(3)C与水反应的化学方程式是_________________________________,写出所得溶液中含有10个电子的微粒符号___________。
五种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
| X |
Y |
|
|
| |
Z |
W |
M |
请按要求回答下列问题:
(1)X元素名称 ,W的离子结构示意图 ;
(2)元素Z位于周期表中的位置是 ;
(3)元素Z可以形成多种单质,请任意写出一种常见单质的名称 ;
(4)Y的最高价氧化物的化学式为____ _;M的最高价氧化物水化物名称为_______;
(5)Z、W、M三种元素中,原子半径最大的是 (填元素符号);这三者与氢元素形成的化合物中,最稳定的是 (填:氢化物的化学式),它的电子式为 ;
(6)X与M可形成XM4型化合物,是一种常见的溶剂,其中的化学键类型是 (填:“离子键”或“共价键”)。
(7)W的氧化物有两种A和B,已知在某一定条件下,A和B能同时相互转化。则在该条件下A 完全转化为B(填:“能”或“不能”)
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。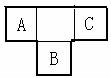
(1)B元素位于元素周期表中第 周期,第 族。
(2)由元素C与Mg元素形成的化合物的化学键的类型 。
(3)由元素A与氢元素形成的化合物的结构式 。
(4)由元素B与氢元素形成的化合物的电子式 。
(5)写出A的气态氢化物与B的最高价氧化物对应的水化物反应的化学方程式: 。
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 |
IA |
|
0 |
|||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
|
|
|
② |
③ |
④ |
|
|
| 3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)⑧的原子结构示意图为_________。
(2)②的气态氢化物分子的结构式为___________,②和⑦的气态氢化物的稳定性相比,其中较弱的是____(用该氢化物的化学式表示)。
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是 (填化学式)
(4)⑤、⑥元素的金属性强弱依次为___________(填“增大”、“减小”或“不变”)
(5)④、⑤、⑥的形成的简单离子半径依次_________(填“增大”、“减小”或“不变”)
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式: ,形成的晶体是 晶体。
化学上常用一条短线来表示一对共用电子对,用元素符号和短线来表示物质结构的式子叫结构式,例如Cl2的结构式用Cl-Cl表示,H2O的结构式用H-O-H表示。
(1)写出下列物质的结构式:
①CO2 ②N2 ;③CH4 ;④C2H4 。
(2)根据下列物质的结构式写出其相应的电子式:
①H―O―Cl_____; ②H-O-O-H_______;
③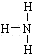 _____; ④H-C≡C-H 。
_____; ④H-C≡C-H 。
.根据要求的化学用语填写
(1)H2O2的电子式为_______________
(2)C2H2的结构式为__________________
(3)常温常压下,1g甲烷完全燃烧生成液态水时放出热量为556kJ,写出甲烷燃烧的热化学方程式__________________________________________________________________
(4)以Fe棒和Cu棒作为两极,氯化铁溶液作为电解质溶液,组成原电池,正极反应式为__________________________________,负极反应式为____________________________
(5)固体离子化合物的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构。它的电子式是____________________
(共10分)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
|
|
|
① |
② |
③ |
|
|
| 3 |
④ |
|
⑤ |
|
|
⑥ |
⑦ |
⑧ |
| 4 |
⑨ |
|
|
|
|
|
|
|
(1)在这些元素中,化学性质最不活泼的是: (填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_____________,碱性最强的化合物的电子式是:_____________。
(3)最高价氧化物是两性氧化物的元素是________;写出它的氧化物与氢氧化钠反应的离子方程式______。
(4)用电子式表示元素④与⑥的化合物的形成过程: ,该化合物属于 (填 “共价”或“离子”)化合物。
(5)表示①与⑦的化合物的电子式 ,该化合物是由 (填“极性”或“非极性”)键形成的。
(共4分)下列五种物质中 ①Ne ②H2O ③NH3 ④KOH ⑤Na2O(填写序号):只存在共价键的是 ,只存在离子键的是 ,既存在共价键又存在离子键的是 ,不存在化学键的是 。
A、B、C、D、E、F是原子序数小于20的四种元素,已知A元素+1价的阳离子与C的阳离子具有相同的电子层结构,B元素最高正价的绝对值与负价的绝对值之差等于6。1molC单质与足量的稀硫酸反应可生成1.5molH2,反应后C元素原子形成的离子和氖原子的电子层结构相同。以D元素为核心可以形成种类最多的一类化合物。E的单质是密度最小的物质。F原子的最外层电子数是核外电子总数的 ;
;
(1)写出A、C两元素最高价氧化物的水化物间反应的离子方程式___________________________;
(2)比较B与C元素形成离子的半径:B元素形成的离子半径______C元素形成的离子半径(填“>”、“=”或“<”)
(3)D与F形成的一种化合物是参与大气循环的气体,写出它的电子式________________;
有X、Y、Z、M 、N按原子序数依次递增的五种短周期元素,其中Z、M、N同周期,X、Z同主族且X是原子半径最小的原子;Y、N同主族,Z+与Y2—具有相同的电子层结构;M的单质晶体熔点高、硬度大,是一种重要的半导体材料。
(1)M的元素名称 ,N在元素周期表中的位置 。
(2)离子半径比较:r(Z+) r(Y2—)。
(3)X与Z形成的化合物A是 (填“离子化合物”或“共价化合物”),A与X2Y反应的化学方程式是 。
试题篮
()