关于氢键,下列说法正确的是
| A.某些含氢元素的化合物中一定有氢键 |
| B.氢键比分子间作用力强,所以它属于化学键 |
| C.DNA中的碱基互补配对是通过氢键来实现的 |
| D.H2O是一种非常稳定的化合物,这是由于氢键所致 |
若不断地升高温度,实现“冰→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的粒子间的主要相互作用力依次是
| A.氢键;分子间作用力;非极性共价键 |
| B.氢键;氢键;极性共价键 |
| C.氢键;极性共价键;分子间作用力 |
| D.分子间作用力;氢键;非极性共价键 |
A、B、C、D、E、F为原子序数依次增大的短周期元素,G为第四周期元素,B、C相邻且同周期,A、D同主族。A、C能形成两种化合物甲和乙,原子个数比分别为2∶1和1∶1,甲为常见的溶剂。E是地壳中含量最多的金属元素。F元素为同周期电负性最大的元素。D和F可形成化合物丙,E和F可形成化合物丁。G为第四周期未成对电子数最多的元素。请回答下列问题:
(1)写出G基态原子的电子排布式
(2)B和C比较,第一电离能较大的元素是 (填元素符号),其原因为
(3)A与B形成的化合物易溶于化合物甲,其主要原因是
(4)甲、乙两分子中含有非极性共价键的是 (填分子式),它中心原子的杂化方式是
(5)已知化合物丁熔点190℃,沸点183℃,结构如右图所示。
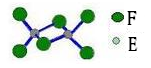
①丙和丁比较,熔点较低的化合物是 (填化学式),其原因为
②则丁含有的作用力有 (填序号)。
A.离子键 B.共价键 C.金属键
D.配位键 E.范德华力
在下列物质中:NaCI、NaOH、Na2O2、H2O2、(NH4)2S、CCI4、C2H2、SiC、晶体硅、金刚石、SO3
①其中只含有离子键的离子晶体是 ;
②其中既有离子键,又有极性键和配位键的离子晶体是 ;
③其中既有离子键,又有非极性键的是 ;
④其中含有非极性键的非极性分子的是 ;
⑤其中含非极性键的极性分子的是 ;
⑥其中含有极性键的的原子晶体是 ;
CoCl3·4NH3用H2SO4溶液处理再结晶,SO42—可以取代化合物中的Cl—,但NH3的含量不变,用过量的AgNO3处理该化合物,有含量1/3氯以AgCl析出,这种化合物应该是
| A.[Co(NH3)4] Cl3 | B.[Co(NH3)4 Cl3] |
| C.[Co(NH3)4 Cl] Cl2 | D.[Co(NH3)4 Cl2] Cl |
有关C2H6、C2H4、C2H2之叙述正确的是
| A.C原子的轨道杂化类型分别为sp、sp2、sp3 |
| B.π键总数:C2H6>C2H4>C2H2 |
| C.σ键总数:C2H6>C2H4>C2H2 |
| D.碳碳键间的键能:C2H6>C2H4>C2H2 |
用VSEPR理论预测BF3和NF3的立体结构,两个结论都正确的是
| A.平面三角形;平面三角形 | B.平面三角形;三角锥形 |
| C.平面三角形;正四面体 | D.直线形;三角锥形 |
下列有关化学键和化合物的叙述正确的是
①共价化合物中只有共价键,离子化合物中一定有离子键
②只含共价键的物质一定是共价化合物
③离子化合物中一定有非金属元素
④离子键和极性键只存在于化合物中
⑤两个非金属原子间不可能形成离子键
| A.①②⑤ | B.②③④ | C.①③④⑤ | D.①③⑤ |
下表为六种短周期元素的部分性质:
| 元素代号 |
X |
Y |
Z |
Q |
R |
T |
| 原子半径/10-10m |
0.77 |
0.74 |
0.75 |
1.17 |
0.99 |
1.10 |
| 主要化合价 |
+4、 -4 |
-2 |
+5、 -3 |
+4、 -4 |
+7、 -1 |
+5、 -3 |
下列有关说法错误的是
A.X与Y可以形成阴离子XY32-
B.元素R的氧化物对应的水化物一定为强酸
C.Z的氢化物的沸点比T的氢化物的沸点高
D.由X形成的化合物XY2和XR4,其中XR4的沸点高
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为________________;A、B、C的电负性由大到小的顺序为___________;(均用“<”或“>”连接)
(2)B的氢化物的分子空间构型是_____________。其中心原子采取_____________杂化。
(3)写出化合物AC2的电子式____________;一种由B、C组成的化合物与AC2互为等电子体,其化学式为____________。
(4)E的价层电子排布式是____________,在形成化合物时它的最高化合价为_____________,ECl3形成的配合物的化学式为________________。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是________________。
X、Y、Z、W 均为主族元素,其原子序数依次增大,且原子序数均小于或等于20。X、Z 处于同一主族,Y、Z 处于同一周期,X 为地壳中含量最多的元素,Y、W 在化合物中均只有一种化合价,分别为+1 和+2。下列说法正确的是
| A.原子半径:Z>Y>X |
| B.X、Y 形成的化合物均为离子化合物,其结构中只有离子键 |
| C.最外层电子数:X=Z>W>Y |
| D.最高正化合价:X=Z>W>Y |
固体NH5属离子化合物。它与水反应的方程式为:NH5+H2O=NH3 ·H2O+H2↑,它也能跟乙醇发生类似的反应,并都产生氢气。下列有关NH5叙述正确的是
| A.1mol NH5中含有5NA个N—H键 |
| B.NH5中N元素的化合价为-5价 |
| C.与水反应时,原理和NaH与水反应相同 |
| D.与乙醇反应时,NH5被还原 |
已知W、X、Y、Z为短周期元素,它们的原子半径依次增大,W与Z、X和Y分别同主族,Y、Z同周期。Z能与X形成两种常见的离子化合物,离子个数比均为2:1。下列说法错误的是
| A.Y、Z、X、W的原子序数依次减小 |
| B.W与X可形成既含极性共价键又含非极性共价键的化合物 |
| C.由W、X、Y、Z四种元素组成的常见化合物一定显酸性 |
| D.X的简单氢化物的沸点低于Y的简单氢化物的沸点 |
试题篮
()