常温下,浓度均为0.1 mol/L的三种溶液:①CH3COOH溶液;②NaOH溶液;③CH3COONa溶液。下列说法不正确的是( )
| A.溶液的pH:②>③>① |
| B.水电离出的c(OH-):③>①>② |
| C.②和③等体积混合后的溶液:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) |
| D.①和②等体积混合后的溶液:c(CH3COOH)+c(CH3COO-)="0.1" mol/L |
下列说法正确的是( )
| A.常温下将pH=2的醋酸和pH=12的NaOH溶液等体积混合,所得溶液显碱性 |
| B.已知同温时氢氟酸的电离常数大于亚硝酸的电离常数,则相同温度相同浓度的NaF溶液和NaNO2溶液的碱性:NaF溶液较强 |
| C.将等体积的盐酸和氨水混合,充分反应后所得溶液呈中性,则两溶液的物质的量浓度关系为:c(HCl)<c(NH3·H2O) |
| D.已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)= c(CO32-),且c(Mg2+)·c(CO32-)=6.82×10-6 |
下列液体均处于25 ℃,有关叙述正确的是( )
| A.Na2CO3溶液中,c(OH-)-c(H+)=c(HCO3-) +2c(H2CO3) |
| B.AgCl在同浓度的MgCl2和KCl溶液中的溶解度相同 |
| C.将稀氨水逐滴加入稀硫酸中,当溶液pH =7时,c(SO42-) >c(NH4+) |
| D.Na2S溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
下列液体均处于25 ℃,有关叙述正确的是 ( )。
| A.某物质溶液的pH>7,则该物质一定是碱或强碱弱酸盐 |
| B.pH=6.5的牛奶中c(H+)是pH=4.5的H2SO4溶液中c(H+)的100倍 |
| C.pH=3的醋酸与pH=11的NaOH溶液等体积混合后溶液中: c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D.AgCl在等浓度的CaCl2溶液和NaCl溶液中的溶解度相同 |
下列有关说法中正确的是( )
| A.常温下,将1 L pH=12的氨水加水稀释为10 L后溶液的pH=11 |
| B.有甲、乙两醋酸溶液,测得甲的pH=a,乙的pH=a+1,若用于中和等物质的量浓度等体积的NaOH溶液,需甲、乙两酸的体积V (乙)>10V(甲) |
C.向浓度均为0.1 mol·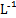 的MgCl2、CuCl2混合溶液中逐滴加入氨水,先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2] 的MgCl2、CuCl2混合溶液中逐滴加入氨水,先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2] |
| D.水的离子积常数KW随着温度的升高而增大,说明水的电离是放热反应 |
常温下,0.1 mol·L-1某一元酸HA溶液中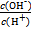 =1×10-12,下列说法中正确的是( )
=1×10-12,下列说法中正确的是( )
| A.溶液中由水电离出的c(H+)=1×10-10 mol·L-1 |
B.溶液中存在HA H++A- H++A- |
| C.与0.1 mol·L-1 NaOH溶液等体积混合后所得溶液为中性 |
| D.原溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大 |
下列有关结论中,正确的是
| A.浓度为0.lmol/LCuSO4溶液,温度升高,溶液的pH降低 |
| B.—元酸与—元碱恰好完全反应后的溶液中—定存在c(H+)=c(OH-) |
C.浓度相同的AlCl3、NH3 H2O、Ba(OH2)三物质的溶液,等体积混合时没有沉淀生成 H2O、Ba(OH2)三物质的溶液,等体积混合时没有沉淀生成 |
| D.在所有能够溶解Al(OH)3的溶液中Cu2+、ClO-、Cl-、 Ca2+一定能够大量共存 |
归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是
①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c (Na+) + c(H+)=c(OH-) + c(CH3COO-)
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;
则有:Ka·Kh=Kw
⑤电解精炼铜时,电解质溶液中铜离子浓度不变 。
| A.①④ | B.①②④ | C.①②④⑤ | D.①②③④ |
室温下,有关下列四种溶液的叙述正确的是(忽略溶液混合的体积变化)
| |
① |
② |
③ |
④ |
| pH |
12 |
12 |
2 |
2 |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
A.在①、②中分别加入氯化铵晶体,两溶液的pH值均增大
B.分别将等体积的①和②加水稀释100倍,所得溶液的pH:①>②
C.把①、④两溶液等体积混合后所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.将溶液②和溶液③等体积混合,混合后所得溶液pH=7
下列说法错误的是
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH小于4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.200 mol·L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度: ④>①>②>③ |
下列叙述正确的是
| A.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:2c(Na+) + c(CH3COOH) = c(CH3COO-) +2c(OH-) |
| B.Ksp(AgCl)>Ksp(AgI)由此可以判断AgCl(S) + I- = AgI(S) + Cl-能够发生 |
| C.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) |
| D.中和浓度与体积均相等的盐酸和醋酸溶液,消耗NaOH的物质的量不相等 |
常温下,pH=11的氨水和pH=1的盐酸等体积混合(混合溶液体积为两溶液体积之和),恰好完全反应,则下列说法错误的是
| A.氨水的浓度大于盐酸的浓度 |
| B.原氨水中有1%的含氮微粒为NH4+ |
| C.氨水中水电离出的c(H+)是盐酸中水电离出的c(H+)的100倍 |
| D.混合溶液中c(NH4+)+c(NH3·H2O)+c(NH3)=5×10-4mol/L |
下列说法正确的是
A.向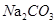 溶液通入 溶液通入 ,可使水解平衡: ,可使水解平衡: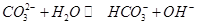 向正反应方向移动,则溶液pH增大 向正反应方向移动,则溶液pH增大 |
B.室温时,0.1mol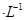 某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4 某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4 |
C.25℃时,pH=13的1.0 L Ba 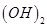 溶液中含有的 溶液中含有的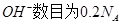 |
| D.用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH |
下列电解质溶液的有关叙述正确的是
| A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 |
| B.在含有BaSO4沉淀的溶液中加入K2SO4固体,c(Ba2+)增大 |
| C.含l mol KOH的溶液与l mol CO2完全反应后,溶液中c(K+)>c(HCO3-) |
| D.在(NH4)2SO4溶液中加入适量H2SO4,可使c(NH4+)=2c(SO42-) |
下列说法错误的是
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH小于4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.200 mol·L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度: ④>①>②>③ |
试题篮
()