下列说法正确的是
A.常温下在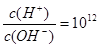 的溶液中能大量共存的离子组:Na+、NO3-、I-、SO42- 的溶液中能大量共存的离子组:Na+、NO3-、I-、SO42- |
| B.ALCL3溶液与过量氨水反应的离子方程式为:Al3++4OH-=[Al(OH)4]- |
| C.某温度下的醋酸铵溶液呈中性,则溶液中:c(H+)=c(OH-)=10-7mol·L-1 |
| D.0.1mol·L-1的NaHSO3溶液中:c(HSO3-)+C(SO32-)+c(H2SO3)=0.1mol·L-1 |
下列关于常温下电解质溶液的叙述中,正确的是
| A.碳酸氢按溶液和足量氢氧化钠溶液混合,反应的离子方程式为:HCO- 3+OH-=CO2- 3+H2O |
| B.25℃时,pH=8的0.lmol·L-1NaX溶液中由水电离出的c(OH-)=1×10-8mol·L-1 |
| C.等物质的量浓度的NH4Cl溶液和NH3·H2O溶液中,c(NH+ 4)前者小于后者 |
| D.等物质的量浓度、等体积的氨水和盐酸混合后,c(H+)+c(NH+ 4)=c(Cl-)+c(OH-) |
25℃时,有关弱酸的电离平衡常数如下,下列有关说法正确的是
| 弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25℃) |
1.8×10-5 |
4.9×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
A.等物质的量浓度的各溶液pH关系为pH(CH3COONa)>pH(Na2CO3)>pH(NaCN)
B.a mol·L-1HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定小于b
C.0.1 mol·L-1CH3COOH溶液中逐滴加入水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
常温下,实验室有0.01mol•L-1醋酸,下列叙述正确的是
| A.c (CH3COO-) + c (OH-)=" 0.01" mol•L-1 |
| B.与等体积pH = 12的氨水混合后所得溶液显碱性 |
| C.加入少量醋酸钠固体后所得溶液中c (CH3COO-)减小 |
| D.与等体积0.01 mol•L-1NaNO3溶液混合后有:c (NO3-) =" c" (CH3COO-)+c (CH3COOH) |
化学知识在生活中有重要意义,下列说法不正确的是
| A.草木灰(含有K2CO3)水溶液可以用于洗涤油污 |
| B.乙醇、乙酸和甲醛广泛应用于食品加工 |
| C.捕获排放的CO2能降低地球的温室效应 |
| D.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
下列说法正确的是
| A.常温下,pH = 7的氨水与氯化铵的混合溶液中:c(Cl-) = c(NH4+) |
| B.常温下pH = 5的盐酸溶液稀释1000倍后pH = 8 |
| C.在BaSO4的饱和溶液中加入一定量Na2SO4固体,BaSO4的溶解度和Ksp均变小 |
| D.0.1 mol·L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+) |
醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是
| A.醋酸溶液中:c(H+)>c(CH3COO-)>c(OH-) |
| B.NaHCO3溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-) |
| C.等体积、等物质的量浓度的醋酸与氢氧化钠溶液混合:c(Na+)=c(CH3COO-) |
| D.中和等体积、等物质的量浓度的CH3COOH溶液和HCl溶液所消耗的NaOH物质的量相等 |
下列叙述正确的是
| A.0.1 mol·L-1醋酸溶液中:c(H+)= c(CH3COO-)+c(OH-) |
| B.中和pH与体积都相同的硫酸和醋酸,消耗NaOH的量后者大于前者 |
| C.同温度同浓度的NaOH和澄清石灰水中,水的电离程度相同 |
| D.NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(OH-)>c(H+) |
室温时,0.1 mol·L-1的HA溶液的pH=3,向该溶液中逐滴加入NaOH,在滴加过程中,有关叙述正确的是
| A.原HA溶液中,c(H+)=c(OH-)+c(A-) |
| B.当滴入少量的NaOH,促进了HA的电离,溶液的pH降低 |
| C.当恰好完全中和时,溶液呈中性 |
| D.当NaOH溶液过量时,可能出现:c(A-)>c(Na+)>c(OH-)>c(H+) |
下列叙述正确的是
| A.相同温度下,中和pH=1的盐酸和醋酸各20.0mL,需要0.100 mol·L-1NaOH都是20.0mL |
| B.0.1mol·L-1Na2CO3中加入少量NaOH固体后振荡,c(Na+)和c(CO32-)都增大 |
| C.常温下,向AgCl悬浊液中加入少量NaCl固体后振荡,Ksp(AgCl)增大 |
| D.相同浓度的CH3COOH和 CH3COONa溶液等体积混合后,则:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
常温下,实验室有0.01mol·L-1醋酸,下列叙述正确的是
| A.c (CH3COO-) + c (OH-)=" 0.01" mol·L-1 |
| B.与等体积pH = 12的氨水混合后所得溶液显碱性 |
| C.加入少量醋酸钠固体后所得溶液中c (CH3COO-)减小 |
| D.与等体积0.01 mol·L-1NaNO3溶液混合后有:c (NO3-) =" c" (CH3COO-)+c (CH3COOH) |
对于常温下0.1mol·L-1 NaHCO3溶液,下列叙述不正确的是( )
| A.c (Na+)="c" (HCO3-) + c (CO32-) + c (H2CO3) |
| B.温度升高,溶液的pH升高,但溶液中的c(H+)与c(OH-)乘积不变 |
| C.与等体积等浓度的CH3COOH溶液反应后,溶液中c(Na+)>c(CH3COO-) |
| D.加入适量的NaOH固体,溶液的pH减小 |
常温下,下列有关叙述正确的是
A.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合: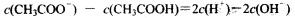 |
B.Na2CO3溶液中,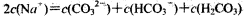 |
C.pH相等的CH3COONa、NaClO、NaHCO3三种溶液: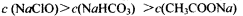 |
D.NH4Cl溶液和NaOH溶液混合所得的中性溶液中: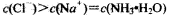 |
硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(1) [B(OH)4]-(aq)+H+(aq)。
[B(OH)4]-(aq)+H+(aq)。
下列说法正确的是
| 化学式 |
电离常数(298K) |
| 硼酸 |
K=5.7×10-10 |
| 碳酸 |
K1=4.4×10-7 K=4.7×10-11 |
| 醋酸 |
K=1.75×10-5 |
A.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气 泡产生
B.将一滴醋酸溶液滴入碳酸溶液中一定能观察到有气泡产生
C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
D.等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH:前者>后者
常温下,下列叙述错误的是
A.向0.1mol·L-1的醋酸溶液中加水或通入HCl气体都能使 值增大 值增大 |
| B.0.1mol·L-1的醋酸钠溶液20mL与0.1mol·L-1盐酸10mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) |
| C.pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7 |
D.0.1mol·L-1某一元酸HA溶液中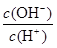 =1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol/L =1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol/L |
试题篮
()