下列说法中正确的是( )
A.如果盐酸的浓度是醋酸的两倍,则盐酸中的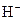 浓度也是醋酸中的两倍 浓度也是醋酸中的两倍 |
B.将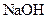 溶液和氨水各稀释一倍,两者的 溶液和氨水各稀释一倍,两者的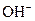 浓度均减小到原来的 浓度均减小到原来的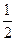 |
| C.中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠多于醋酸 |
| D.弱电解质溶液的导电能力也可能比强电解质溶液的强 |
下列溶液中,微粒的浓度关系正确的是
| A.0.1mol·L-1 pH为4的NaHSO3溶液中:c(HSO3―) > c(SO32―)> c(H2SO3) |
| B.等体积等物质的量浓度NaF 溶液与HF混合:c(Na+)=c(F―)+c(HF) |
| C.在NaHA溶液中一定有:c(Na+)+c(H+) = c(HA―)+c(OH―)+c(A2-) |
| D.c(NH4+)相等浓度的(NH4)2CO3、(NH4)2SO4和(NH4)2Fe(SO4)2三份溶液物质的量浓度依次增大 |
下列各组离子一定能大量共存的是
A.在含大量Fe3+的溶液中: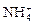 、 、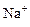 、 、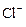 、I― 、I― |
| B.常温下,pH=12的溶液中:SO32―、Cl―、K+、SiO32- |
C.在pH=1的溶液中: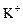 、 、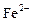 、 、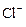 、 、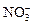 |
D.在无色透明溶液中: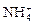 、 、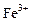 、 、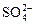 、 、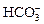 |
下列事实不能用勒沙特列原理解释的是 ( )
| A.浓度均为0.1 mol·L-1的新制氯水,加入少量NaHSO3晶体,片刻后,溶液中HClO 分子的浓度减小 |
| B.室温下,将1 mL pH=3的醋酸溶液加水稀释至100 mL后,测得其pH<5 |
| C.在硫化氢水溶液中加入碱有利于S2—的生成 |
| D.500℃左右比室温更利于合成氨反应 |
常温下,下列各组数据中比值为2:1的是:
| A.电解熔融氯化钠,在阴极和阳极上析出产物的物质的量之比 |
| B.中和体积相同、pH相同的硫酸和盐酸消耗NaOH的物质的量之比 |
| C.1 mol·L-1氨水溶液与0.5 mol·L-1氨水溶液中c(OH-)之比 |
| D.等物质的量浓度(NH4)2SO4和NH4Cl的C(NH4+)之比 |
下列说法中,正确的是:
| A.0.1 mol·L-1的醋酸溶液加水稀释,c(H+)、c(OH-)同比例减小 |
| B.体积相同、pH相同的NH4Cl溶液、盐酸,完全溶解少量且等同的锌粉,前者用时少 |
| C.将nmol H2(g)、n mol I2(g)和2n mol H2 (g)、2n mol I2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者 |
| D.室温下,某溶液中由水电离的出H+浓度为10-amol/L,a<7时,溶液的pH为a或14 -a |
一定量混合气体在密闭容器中发生如下反应:xA(气)+yB(气) zC(气),达平衡后测得A气体的浓度为0.50 mol/L。恒温下将容器扩大1倍,反应重新平衡,测得A浓度为0.30mol/L。下列叙述中正确的是: 
| A.x+y<z | B.平衡向右移动 | C.B的转化率提高 | D.C的体积百分含量降低 |
天然海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。火力发电燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如下图所示,下列说法错误的是( )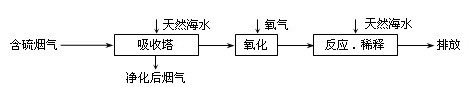
A.天然海水pH ≈ 8的原因是由于海水中的CO32-、HCO3-水解 |
B.“氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42- |
C.“反应.稀释”时加天然海水的目的是中和.稀释经氧化后海水中生成的酸 |
D.“排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同 |
下列叙述中正确的是( )
| A.pH相同的CH3COONa溶液.C6H5ONa溶液.Na2CO3溶液.NaOH溶液: c(CH3COONa)>c(C6H5ONa )>c(Na2CO3)>c(NaOH ) |
| B.在常温下,10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH = 10 |
| C.将pH = 3的一元弱酸HA和pH = 11的NaOH溶液充分混合后一定有: c(OH-)<c(H+)<c(Na+)<c(A-) |
| D.将0.2 mol·L-1的盐酸与0.1 mol·L-1的NaAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(Al3+)<c(H+)<c(Na+)<c(Cl-) |
在Na2S溶液中存在着下列关系不正确的是
| A.c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) | B.c(Na+)>c(S2-)>c(OH-)>c(HS-) |
| C.c(OH-)=c(H+)+c(HS-)+2c(H2S) | D.c(Na+)+c(H+)=c(OH-)+c(HS-)+c(S2-) |
下列有关0.1 mol•L-1NaHCO3溶液中离子浓度的关系式,正确的是
| A.c(Na+) > c(HCO3-) > c(CO32-) > c(H+) > c(OH-) |
| B.c(Na+) > c(CO32-) > c(HCO3-) > c(OH-) > c(H+) |
| C.c(Na+) =c(HCO3-) + 2c(CO32-) + c(H2CO3) |
| D.c(Na+) + c(H+) =c(HCO3-) + 2c(CO32-) + c(OH-) |
下列表示反应中电子转移的方向和数目正确的是
| A.MnO2+4HClM失去2e-nCl2+C得到2e-l2↑+2H2O |
| B.3S+6KOH===K2S失去4e-O3+2K2S得到2e-×2+3H2O |
| C.KClO3+6HCl===KCl得到6e-+3C失去6e-l2↑+3H2O |
| D.2KClO12e-3MnO2△2KCl+3O2↑ |
对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是( )
| A.加入适量的氯化铵晶体后,两溶液的pH均减小 | B.温度下降10oC,两溶液的pH均不变 |
| C.分别加水稀释10倍,两溶液的pH仍相等 | D.用盐酸中和,消耗的盐酸体积相同 |
试题篮
()