下列说法正确的一组是( )
①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质
②盐都是强电解质
③0.5 mol·L-1的所有一元酸中氢离子浓度都是0.5 mol·L-1
④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
⑤电解质溶液导电的原因是溶液中有自由移动的阴、阳离子
⑥熔融的电解质都能导电
| A.①③⑤⑥ | B.②④⑤⑥ | C.只有⑤ | D.只有⑥ |
下列叙述正确的是
| A.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合: 2c(Na+) + c(CH3COOH) = c(CH3COO-) +2c(OH-) |
| B.Ksp(AgCl)>Ksp(AgI)由此可以判断AgCl(S) + I- = AgI(S) + Cl-能够发生 |
| C.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) |
| D.中和浓度与体积均相等的盐酸和醋酸溶液,消耗NaOH的物质的量不相等 |
下列说法正确的是
| A.pH=5的盐酸,再加水冲稀1000倍,溶液的pH=8 |
| B.给稀醋酸溶液加热,溶液pH值增大 |
| C.pH=1的盐酸中c(H+)是pH=3的盐酸的c(H+)100倍 |
| D.在H2CO3溶液中,C(H+) :C(CO32—-)=2∶1 |
常温下,向0.25 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是
| A.硫酸溶液的体积为30 mL |
| B.b时刻溶液中SO42-的浓度约为0.125 mol·L-1 |
| C.d时刻溶液的pH约为13 |
| D.溶液的导电能力:c<d=b<a |
在T ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g/cm3,溶质的质量分数为w,其中含NH4+的物质的量为b mol。下列叙述中正确的是( )
A.溶质的质量分数为w= ×100% ×100% |
B.溶质的物质的量浓度c= mol/L mol/L |
C.溶液中c(OH-)= mol/L mol/L |
| D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w |
下列有关实验的操作正确的是( )
| |
实验 |
操作 |
| A |
配制稀硫酸 |
先将浓硫酸加入烧杯中,后倒入蒸馏水 |
| B |
排水法收集 分解产生的 |
先熄灭酒精灯,后移除导管 |
| C |
浓盐酸与 反应制备纯净 |
气体产物先通过浓硫酸,后通过饱和食盐水 |
| D |
萃取碘水中的 |
先从分液漏斗下口放出有机层,后从上口倒出水层 |
| A. | A |
B. | B |
C. | C |
D. | D |
下列说法正确的是
| A.KClO3和SO3溶于水后均能导电,故KClO3和SO3都是电解质 |
| B.常温下将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C.常温下,等浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
| D.25℃时,用pH=3的盐酸滴定等浓度的氨水至溶液的pH=7,V(氨水)<V(盐酸) |
下列推断或表述正确的是 ( )
| A.澄清石灰水与足量小苏打溶液混合的离子方程式为:Ca2++OH-+HCO3- |
| B.向2.0mL浓度均为0.1 mol·L-1的KCl、KI混合液滴加1~2滴0.01 mol·L-1AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp小 |
| C.将体积相同pH均为1的盐酸和醋酸加水稀释至pH为3,盐酸的体积变化大,证明醋酸是弱酸 |
| D.25℃时,pH=4.7,浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液中。(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是
| A.2.0mol/L | B.1.5 mol/L | C.0.18 mol/L | D.0.24mol/L |
下列说法错误的是
| A.反应A(s)+B(g) === C(s)+D(s)能自发进行,则一定有ΔH <0 |
| B.FeS不溶于水,但能溶于稀盐酸中 |
| C.在滴有酚酞的Na2CO3溶液中加入BaCl2溶液,溶液褪色,说明BaCl2溶液有酸性 |
| D.常温条件下,相同大小的钠粒在20mL硫酸铜溶液中比在20 mL纯水中反应更剧烈,是因为硫酸铜溶液中的c(H+)比纯水中的大 |
下列表述正确的是
| A.NaHCO3溶液中:c(H+) + c(H2CO3) =c(OH-) |
| B.中和等体积、等pH相同的盐酸和CH3COOH溶液所消耗的NaOH物质的量相同 |
| C.pH=2的HA溶液与pH=12的MOH溶液以任意比混合后,所得溶液中: c(H+) + c(M+) =c(OH-) + c(A-) |
| D.在水电离出的H+浓度为1×10-12 mol/L的溶液中,K+、Mg2+、NO3-、I-一定能大量共存 |
下列说法正确的是( )
| A.向0.1 mol/L Na2CO3溶液中滴加酚酞,溶液变红色 |
| B.Al3+、NO3-、Cl-、CO32-、Na+可大量共存于pH=2的溶液中 |
| C.乙醇和乙酸都能溶于水,都是电解质 |
| D.分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同 |
下列有关说法正确的是
A.一定条件下反应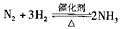 ,达到平衡时, ,达到平衡时,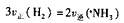 |
| B.10mL浓度为1mol/L的盐酸与过量的Zn粉反应,若加入适量的CH3COONa溶液,既能减慢反应这率,又不影响H2的生成 |
C.将PH=a十l的氨水稀释为pH=a的过程中,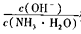 变小 变小 |
| D.常温下,向浓度为0.1 mol/L的CH3COONa溶液中加入等体积等浓度的CH3COOH,混合溶液的pH=7 |
下列有关电解质溶液中粒子浓度关系正确的是
| A.CO2的水溶液中:c(H+)>c(HCO3-)=2c(CO32-) |
| B.pH=1的NaHSO4溶液:c(H+)=c(SO42-)十c(OH-) |
| C.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) |
| D.等物质的量浓度的NH4HSO4溶液和NH4Cl溶液,c(NH4+)前者小 |
试题篮
()