常温下,向0.25 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是
| A.硫酸溶液的体积为30 mL |
| B.b时刻溶液中SO42-的浓度约为0.125 mol·L-1 |
| C.d时刻溶液的pH约为13 |
| D.溶液的导电能力:c<d=b<a |
常温离子液体(又称常温熔融盐),是当前化学研究的热点和前沿。1914年报道的第一种离子液体硝酸乙基铵[(C2H5NH3)NO3]的熔点为12℃。已知C2H5NH2的化学性质与NH3相似,下列有关硝酸乙基铵的说法中,正确的是
| A.该离子液体可以作为电池的电解质 |
| B.硝酸乙基铵水溶液呈碱性 |
| C.(C2H5NH3)NO3能与NaOH反应产生NH3 |
| D.硝酸乙基铵水解的离子方程式可表示为:C2H5NH3++H2O=C2H5NH2+H3O+ |
下列电解质溶液的有关叙述正确的是
| A. |
同浓度、同体积的强酸与强碱溶液混合后,溶液的
|
| B. |
在含有
|
| C. |
含l
|
| D. |
在
|
下列有关实验的操作正确的是( )
| |
实验 |
操作 |
| A |
配制稀硫酸 |
先将浓硫酸加入烧杯中,后倒入蒸馏水 |
| B |
排水法收集 分解产生的 |
先熄灭酒精灯,后移除导管 |
| C |
浓盐酸与 反应制备纯净 |
气体产物先通过浓硫酸,后通过饱和食盐水 |
| D |
萃取碘水中的 |
先从分液漏斗下口放出有机层,后从上口倒出水层 |
| A. | A |
B. | B |
C. | C |
D. | D |
下列说法正确的是
| A.KClO3和SO3溶于水后均能导电,故KClO3和SO3都是电解质 |
| B.常温下将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C.常温下,等浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
| D.25℃时,用pH=3的盐酸滴定等浓度的氨水至溶液的pH=7,V(氨水)<V(盐酸) |
硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(1) [B(OH)4]-(aq)+H+(aq)。
[B(OH)4]-(aq)+H+(aq)。
下列说法正确的是
| 化学式 |
电离常数(298K) |
| 硼酸 |
K=5.7×10-10 |
| 碳酸 |
K1=4.4×10-7 K=4.7×10-11 |
| 醋酸 |
K=1.75×10-5 |
A.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气 泡产生
B.将一滴醋酸溶液滴入碳酸溶液中一定能观察到有气泡产生
C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
D.等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH:前者>后者
下列有关说法正确的是
A.一定条件下反应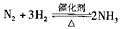 ,达到平衡时, ,达到平衡时,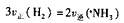 |
| B.10mL浓度为1mol/L的盐酸与过量的Zn粉反应,若加入适量的CH3COONa溶液,既能减慢反应这率,又不影响H2的生成 |
C.将PH=a十l的氨水稀释为pH=a的过程中,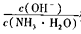 变小 变小 |
| D.常温下,向浓度为0.1 mol/L的CH3COONa溶液中加入等体积等浓度的CH3COOH,混合溶液的pH=7 |
下列有关电解质溶液中粒子浓度关系正确的是
| A.CO2的水溶液中:c(H+)>c(HCO3-)=2c(CO32-) |
| B.pH=1的NaHSO4溶液:c(H+)=c(SO42-)十c(OH-) |
| C.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) |
| D.等物质的量浓度的NH4HSO4溶液和NH4Cl溶液,c(NH4+)前者小 |
下列说法正确的是( )
A.图甲表示某温度下,  在溶液中达到沉淀溶解平衡后,改变溶液PH, 在溶液中达到沉淀溶解平衡后,改变溶液PH, 浓度的变化。由图可知 浓度的变化。由图可知 点溶液未达到饱和,因此, 点溶液未达到饱和,因此, 点的 点的 ]小于 ]小于 点。 点。 |
B.图乙表示在室温时用一定浓度的盐酸滴定V 同浓度的氨水。 同浓度的氨水。 点时溶液中 点时溶液中 = = ,且溶液中水的电离程度最大。 ,且溶液中水的电离程度最大。 |
C.图丙表示在室温时,用  溶液滴定30.00ml0.1mol/L 溶液滴定30.00ml0.1mol/L 溶液,点a所示溶液中C( 溶液,点a所示溶液中C( > > )> )> > > |
D.图丁可表示同体积同PH的某一元强酸溶液①和某一元中强酸溶液②分别与足量的锌粉发生反应生成 随时间( 随时间( )的变化情况。 )的变化情况。 |
下列叙述正确的是 ( )
| A.0.1mol/L醋酸溶液中:c(H+) = c(CH3COO- ) +c(OH- ) |
| B.中和pH与体积都相同的硫酸和醋酸,消耗NaOH的量后者大于前者 |
| C.由水电离的H+浓度为1.0×10-4mol/L的溶液,pH一定等于4 |
| D.NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3) >c(OH-)>c(H+) |
在标准状况下 ,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为c mol/L。下列叙述中正确的是( )
,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为c mol/L。下列叙述中正确的是( )
①ω= ②c=
②c=
③上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
④上述溶液中再加入1.5VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:
c(Cl-) > c(NH4+) > c(H+) > c(OH-)
| A.①④ | B.②③ | C.①③ | D.②④ |
将足量的CO2慢慢通入一定体积的NaOH溶液中,溶液的pH随CO2的体积(已经折算成标准状况)的变化曲线如图所示(不考虑过量的CO2在水中的溶解和反应过程中溶液体积的变化),则下列说法不正确的是( )
| A.NaOH溶液的物质的量浓度为0.1mol/L |
| B.NaOH溶液的体积为2L |
| C.M点离子浓度的大小关系满足c(HCO3-)>c(CO32-) |
| D.M、N点对应的纵坐标均大于7 |
下列说法正确的是
| A.将氯化铝和硫酸铝溶液蒸干灼烧后均得到氧化铝 |
| B.向足量饱和石灰水中加入0.56 g CaO,可得固体0.74 g |
| C.由碱金属元素形成的单质熔点随原子序数的递增逐渐降低 |
| D.向稀醋酸中加入醋酸钠固体,溶液pH升高的主要原因是醋酸钠水解呈碱性 |
醋酸溶液中存在电离平衡CH3COOH H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
| A.0.10mol/L醋酸溶液中粒子浓度的关系满足: c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) |
| B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 |
| C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 |
| D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液pH<7 |
试题篮
()