下列说法正确的是
| A.KClO3和SO3溶于水后均能导电,故KClO3和SO3都是电解质 |
| B.常温下将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C.常温下,等浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
| D.25℃时,用pH=3的盐酸滴定等浓度的氨水至溶液的pH=7,V(氨水)<V(盐酸) |
将足量的CO2慢慢通入一定体积的NaOH溶液中,溶液的pH随CO2的体积(已经折算成标准状况)的变化曲线如图所示(不考虑过量的CO2在水中的溶解和反应过程中溶液体积的变化),则下列说法不正确的是( )
| A.NaOH溶液的物质的量浓度为0.1mol/L |
| B.NaOH溶液的体积为2L |
| C.M点离子浓度的大小关系满足c(HCO3-)>c(CO32-) |
| D.M、N点对应的纵坐标均大于7 |
已知25℃时有关
弱酸的电离平衡常数:则下列有关说法正确的是
| 弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25℃ ) |
1.8×l0-5 |
4.9×l0-10 |
K1=4.3×l0-7 K2=5.6×l0 -11 |
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L—1 HCN溶液与b mol·L—1 NaOH溶液等体积混合后,所得溶液中
c(CN-)>c(Na+),则a一定大于b
C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+ c(H+)=c(OH-)+ c(HCO3-) +2c(CO32-)
某密闭绝热容器中盛有饱和Ca(OH)2溶液,加入少量CaO粉末,下列说法正确的是
①一定有固体析出 ②溶质的质量一定增加 ③溶剂的质量一定减少 ④pH一定减小
| A.①②③④ | B.①②③ | C.①③④ | D.②④ |
下列化学原理表述正确的是
| A.氢硫酸溶液加水稀释,电离程度增大,H+浓度增大; |
| B.Na2CO3溶液中满足:c(Na+)=2c( CO32-)+2 c( HCO3-)+ 2c (H2CO3) |
C.NaHCO3溶液不显中性的原因:HCO3-+H2O CO32-+H3O+ CO32-+H3O+ |
| D.同体积同pH的盐酸和醋酸,与足量的锌反应,盐酸的反应速率快,生成H2的物质的量多; |
从下列事实所引出的相应结论,正确的是
| 选项 |
实验事实 |
结论 |
| A |
等体积pH同为3的酸HA和酸HB与足量Zn反应,酸HA放出氢气多 |
酸性:HA > HB |
| B |
Na2SO4溶液的pH小于Na2CO3溶液的pH |
非金属性:S > C |
| C |
电解同浓度的A2+和B2+硝酸盐的混合溶液,A先析出 |
金属性:A > B |
| D |
由M、N与稀硫酸构成的原电池中,M上产生大量气泡 |
金属性:M > N |
下列有关说法正确的是
A.一定条件下反应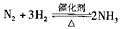 ,达到平衡时, ,达到平衡时,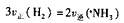 |
| B.10mL浓度为1mol/L的盐酸与过量的Zn粉反应,若加入适量的CH3COONa溶液,既能减慢反应这率,又不影响H2的生成 |
C.将PH=a十l的氨水稀释为pH=a的过程中,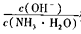 变小 变小 |
| D.常温下,向浓度为0.1 mol/L的CH3COONa溶液中加入等体积等浓度的CH3COOH,混合溶液的pH=7 |
下列有关电解质溶液中粒子浓度关系正确的是
| A.CO2的水溶液中:c(H+)>c(HCO3-)=2c(CO32-) |
| B.pH=1的NaHSO4溶液:c(H+)=c(SO42-)十c(OH-) |
| C.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) |
| D.等物质的量浓度的NH4HSO4溶液和NH4Cl溶液,c(NH4+)前者小 |
下列化学过程及其表述正确的是 ( )
| A.向NaSO,溶液中滴人Ba(OH)2溶液呈中性 H++SO2-4+Ba2++OH-===BaSO4↓+H2O |
| B.由水电离的c(H+)=10-13mol·L-1的溶液中,Na+、NO-3、SO2-4、Cl-能大量共存 |
| C.向含有1mol KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时,沉淀的总物质的量为3 mol |
| D.我国首创的海洋铝电池,采用铂网作为正极,该电池负极的电极反应式为: |
O2+2H2O+4e-→4OH-
下列判断正确的是 ( )
A.在稀氨水中加水稀释, 会增大 会增大 |
| B.若酸性HA>HB,则等物质的量浓度等体积的NaA和NaB溶液混合有关系: c(OH-)>c(A-)>c(B-)>c(H+) |
| C.0.1 mol·L-1的一组溶液pH由大到小排列为: NaOH>Na2CO3>NaHSO4>(NH4)2SO4 |
| D.分别稀释10mLpH=1的盐酸和醋酸至100mL,后者pH变化大,说明醋酸是弱酸 |
某溶液中只含有Na+、H+、OH-、X-四种离子,下列说法正确的是
| A.溶液中不可能存在:c(Na+)>c (X-)>c(OH-)>c(H+) |
| B.若c(OH-)>c(H+),溶液中不可能存在:c(Na+)>c(OH-)>c(X-)>c(H+) |
| C.若溶液中c(X-) = c(Na+),则溶液一定呈中性 |
| D.若溶质为NaX、HX,则一定存在:c(X-)>c(Na+)>c(H+)>c(OH-) |
今有室温下四种溶液,有关叙述不正确的是
| |
① |
② |
③ |
④ |
| 浓度c/mol/L |
0.1 |
0.1 |
0.1 |
0.1 |
| 溶液 |
氨水 |
CH3COONa溶液 |
醋酸 |
盐酸 |
| A.在20mL①溶液中逐滴加入③溶液,溶液导电能力变化如下图(1)所示 |
| B.②、③两溶液等体积混合,离子浓度:2c(Na+)=c(CH3COO-)+c(CH3COOH) |
C.用③滴定①,用酚酞作指示剂,滴定曲线如下图(2)所示: |
| D.①、④两溶液等体积混合,离子浓度:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
常温下,对下列四种溶液的叙述正确的是 ( )
| |
① |
② |
③ |
④ |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸溶液 |
盐酸 |
| pH |
11 |
11 |
3 |
3 |
A.②、③两溶液相比,溶液中水的电离程度不相同
B.四种溶液分别加水稀释10倍,pH变化最大的是①和⑧
C.①、②、③中分别加入少量的醋酸铵固体后,三种溶液的pH均减小
D.①、④两溶液按一定体积比混合,所得溶液中离子浓度的关系不存在:
c(H+)>c(Cl—)>c(OH—)>c(NH+4)
某ⅠA族金属的酸式盐AHB溶液,在室温下呈弱碱性。下列说法正确的是
A.该盐的电离方程式为:AHB A++H++B2- A++H++B2- |
| B.AHB溶液中加入少量的AOH,HB-的电离度增大,c(H+)增大 |
| C.AHB 溶液各离子的物质的量浓度大小顺序为:c(A+)>c(HB-)>c(OH-)>c(H+) |
| D.中和等物质的量的H2B和H2SO4所需NaOH的量前者大于后者 |
试题篮
()