常温下,pH=11的氨水和pH=1的盐酸等体积混合(混合溶液体积为两溶液体积之和),恰好完全反应,则下列说法错误的是
| A.氨水的浓度大于盐酸的浓度 |
| B.原氨水中有1%的含氮微粒为NH4+ |
| C.氨水中水电离出的c(H+)是盐酸中水电离出的c(H+)的100倍 |
| D.混合溶液中c(NH4+)+c(NH3·H2O)+c(NH3)=5×10-4mol/L |
一定条件下,下列说法正确的是
| A.常温时,把pH=1的醋酸溶液稀释10倍后,其pH=2 |
| B.常温时,向CaCO3的饱和溶液中加入Na2CO3固体,则CaCO3的溶度积常数增大 |
| C.向氨水中加入氯化铵固体,会使溶液的pH减小 |
| D.稀释Na2CO3溶液,溶液中c(OH—)增大 |
常温下,向0.25 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是
| A.硫酸溶液的体积为30 mL |
| B.b时刻溶液中SO42-的浓度约为0.125 mol·L-1 |
| C.d时刻溶液的pH约为13 |
| D.溶液的导电能力:c<d=b<a |
下列反应的离子方程式正确的是
| A.物质的量浓度相等的碳酸氢钡溶液和氢氧化钠溶液等体积混合 Ba2+ + 2HCO3- + 2OH- = BaCO3↓+CO32- + 2H2O |
|
| B.NaHSO4溶液中滴加入Ba(OH)2溶液至中性 电解 |
C.以石墨作电极电解氯化镁溶液:2Cl-+2H2O ="==" 2OH-+H2↑+Cl2↑ |
D.碳酸氢钠溶液加入氯化铝溶液 3HCO3-+Al3+ 3CO2+Al(OH)3 3CO2+Al(OH)3 |
下列有关实验的操作正确的是( )
| |
实验 |
操作 |
| A |
配制稀硫酸 |
先将浓硫酸加入烧杯中,后倒入蒸馏水 |
| B |
排水法收集 分解产生的 |
先熄灭酒精灯,后移除导管 |
| C |
浓盐酸与 反应制备纯净 |
气体产物先通过浓硫酸,后通过饱和食盐水 |
| D |
萃取碘水中的 |
先从分液漏斗下口放出有机层,后从上口倒出水层 |
| A. | A |
B. | B |
C. | C |
D. | D |
下列说法正确的是
| A.KClO3和SO3溶于水后均能导电,故KClO3和SO3都是电解质 |
| B.常温下将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C.常温下,等浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
| D.25℃时,用pH=3的盐酸滴定等浓度的氨水至溶液的pH=7,V(氨水)<V(盐酸) |
下列有关说法正确的是
A.一定条件下反应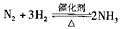 ,达到平衡时, ,达到平衡时,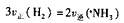 |
| B.10mL浓度为1mol/L的盐酸与过量的Zn粉反应,若加入适量的CH3COONa溶液,既能减慢反应这率,又不影响H2的生成 |
C.将PH=a十l的氨水稀释为pH=a的过程中,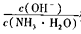 变小 变小 |
| D.常温下,向浓度为0.1 mol/L的CH3COONa溶液中加入等体积等浓度的CH3COOH,混合溶液的pH=7 |
下列有关电解质溶液中粒子浓度关系正确的是
| A.CO2的水溶液中:c(H+)>c(HCO3-)=2c(CO32-) |
| B.pH=1的NaHSO4溶液:c(H+)=c(SO42-)十c(OH-) |
| C.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) |
| D.等物质的量浓度的NH4HSO4溶液和NH4Cl溶液,c(NH4+)前者小 |
已知:25°C时,,
。下列说法正确的是()

| A. |
25°C时,饱和 |
| B. |
25°C时,在 |
| C. |
25°C时, |
| D. |
25°C时,在 |
25 ℃时,浓度均为0.2的
和
溶液中,下列判断不正确的是()

| A. |
均存在电离平衡和水解平衡 |
| B. |
存在的粒子种类相同 |
| C. |
|
| D. |
分别加入 |
下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是( )
| A.Na和O2 | B.NaOH和CO2 | C.NaHCO3和NaOH | D.Na2CO3和HCl |
某溶液中只含有Na+、H+、OH-、A-四种离子,下列说法不正确的是( )
A.此溶液中的溶质有可能是一种,也可能是两种
B.溶液中可能存在:c(Na+)> c(OH-) >c(H+) > c (A-)
C.溶液中可能存在:c(Na+)> c(A-) > c(OH-)>c(H+)
D.若溶质为NaA、NaOH,则一定存在:c(Na+) > c(A-) > c(OH-)> c(H+)
25 ℃时,在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2 mol/L CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论正确的是
| A.a=12.5,且混合溶液pH=7 |
| B.对应曲线上E、F之间的任何一点,溶液中都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| C.P点时,c(CH3COO-)>c(Na+)>c(H+)=c(OH-) |
| D.K点时,c(CH3COO-)+c(CH3COOH)=2c(Na+) |
下列说法正确的是
| A.pH=5的盐酸,再加水冲稀1000倍,溶液的pH=8 |
| B.给稀醋酸溶液加热,溶液pH值增大 |
| C.pH=1的盐酸中c(H+)是pH=3的盐酸的c(H+)100倍 |
| D.在H2CO3溶液中,C(H+) :C(CO32—-)=2∶1 |
试题篮
()