已知25℃时,有关弱酸的电离平衡常数:
| 弱酸 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数 |
1.8×10-5 |
4.9×10-10 |
Ka1=4.3×10-7 Ka2=5.6×10-11 |
则下列有关说法不正确的是
A.25℃时,0.1mol·L-1溶液的pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等
C.25℃时,同浓度的醋酸和氢氧化钠等体积混合,所得溶液pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
室温下,下列叙述正确的是(溶液体积变化忽略不计)
| |
① |
② |
③ |
④ |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
| pH |
11 |
11 |
3 |
3 |
A.在①、②中分别加入氯化铵晶体,两溶液的pH均增大
B.①、④两溶液等体积混合,所得溶液中c(C1-)>c(NH4+)>c(OH-)>c(H+)
C.②、③两溶液混合,若所得溶液的pH=7,则c(CH3COO-)>c(Na+)
D.分别将等体积的③和④加水稀释100倍,所得溶液的pH:③<④
下列说法或表述正确的是
| A.由水电离产生的c(H+)=1×10-2mol•L-1溶液中,可能存在:CO32-、NH4+、Cl-、Na+ |
| B.某醋酸稀溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| C.Ba(OH)2溶液中加人过量的Al2(SO4)3溶液,其离子方程式为: 3Ba2++6OH- +2Al3++3SO42-=3BaS04↓+2Al(OH)3↓ |
| D.物质的量浓度均为1 mol•L-1的NaCl和MgCl2混合液中,含有Cl-的数目为3NA(NA表示阿伏加德罗常数的值) |
下列叙述错误的是
A.把a L 0.1 mol/L 的CH3COOH溶液与b L 0.1 mol/L的 KOH溶液  混合,所得溶液中一定存在:c (K+)+ c (H+) = c (CH3COO-) + c (OH-) 混合,所得溶液中一定存在:c (K+)+ c (H+) = c (CH3COO-) + c (OH-) |
| B.把0.1 mol/L 的NaHCO3溶液与0.3 mol/L 的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c (OH-) >c (Ba+)>c (Na+)> c (H+) |
| C.常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同 |
| D.向1 mol/L 的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 |
下列说法正确的是
| A.pH=5的NH4Cl溶液或醋酸中,由水电离出的c(H+)均为10-9 mol/L |
| B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH的别为a和a+1,则c1=10c2 |
| C.在c(H+)∶c(OH-)=1∶1012的溶液中,Na+、I-、NO3-、SO42-能大量共存 |
| D.0.1 mol/L Na2CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
已知25 ℃时有关弱酸的电离平衡常数如下表:
| 弱酸的化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25℃) |
1.8×10-5 |
4.9×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
则下列有关说法正确的是
A.各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)
B.a mol·L-1HCN溶液与b mol·L-1NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b
C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO)+2c(CO)
下列说法正确的是
| A.向0.1 mol·L-1 Na2CO3溶液中滴加酚酞,溶液变红色 |
| B.Al3+、NO3—、Cl-、CO32—、Na+可大量共存于pH=2的溶液中 |
| C.乙醇和乙酸都能溶于水,都是电解质 |
| D.分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同 |
下列叙述正确的是
| A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) |
| B.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 |
| C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
D.向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中 增大 增大 |
下列叙述正确的是:
| A.0.1 mol/LCH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| C.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降 |
| D.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等 |
下列叙述中正确的是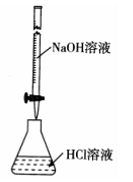
| A.根据上图,若滴定前仰视读数,滴定终点时俯视读数,则测定的盐酸浓度偏高 |
| B.25℃时,难溶物XY和AB3的KSP分别为1.0×10-10和2.7×10-15,则饱和溶液中C(X+)一定大于C(A3+) |
| C.每个Fe(OH)3胶体粒子含一个氢氧化铁分子 |
| D.某溶液中存在K+、HCO-3、CO2-3、OH-、H+,其离子浓度大小顺序可能为c(K+)>c(HCO-3)>c(H+)>c(CO32-) |
醋酸溶液中存在电离平衡:CH3COOH(aq) H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
| A.CH3COOH溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) |
| B.0.1 mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)减小 |
| C.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动 |
| D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
关于电解质溶液下列说法中不正确的是
A.向浓度均为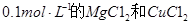 混合溶液中逐滴加入氨水,先生成蓝色 混合溶液中逐滴加入氨水,先生成蓝色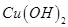 沉淀,则 沉淀,则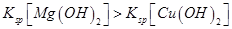 |
| B.用等浓度的NaOH溶液中和等体积pH=2与pH=3的醋酸,所消耗的NaOH溶液的体积前者是后者的10倍 |
C.由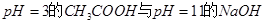 溶液等体积混合,其离子浓度的顺序为: 溶液等体积混合,其离子浓度的顺序为: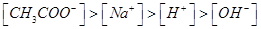 |
D.某温度下纯水中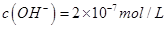 ,则该温度下0.1mol/L的盐酸的pH=1 ,则该温度下0.1mol/L的盐酸的pH=1 |
下列说法正确的是( )
| A.室温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NAHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.200 0 mol·L-1 NAOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度:①>④=②>③ |
常温下体积相同的下列四种溶液:①pH=3的盐酸 ②pH=3的醋酸溶液 ③pH=11的氨水 ④pH=11的NaOH溶液。下列说法中,正确的是
| A.②和④混合,所得混合溶液的pH大于7 |
| B.将四种溶液分别稀释到体积为原的100倍,溶液pH大小顺序③>④>②>① |
| C.③和④分别与足量稀硫酸中和,消耗硫酸的体积③=④ |
| D.①和③混合,所得混合溶液中c(H+)+ c(NH4+)=c(Cl-)+c(OH-) |
向20mL 0.5mol/L的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法错误的是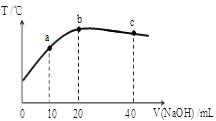
| A.醋酸的电离平衡常数:b点>a点 |
| B.由水电离出的c(OH—):b点>c点 |
| C.从a点到b点,混合溶液中可能存在:c(CH3COO—)= c(Na+) |
| D.b点到c点,混合溶液中一直存在:c(Na+)>c(CH3COO—)>c(OH—)>c(H+) |
试题篮
()