下列关于电解质溶液中离子关系的说法正确的是
| A.0.1mol·L-1NaHCO3溶液中离子浓度关系:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) |
| B.0.1mol·L-1NH4Cl和0.1mol·L-1NH3·H2O等体积混合后离子浓度关系:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C.常温下,向醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中:c(Na+)=c(CH3COO-) |
| D.常温下,在pH=1的溶液中,Fe2+、NO3-、ClO-、Na+能大量共存 |
下表是在相同温度下三种酸的一些数据,下列判断正确的是( )
| 酸 |
HX |
HY |
HZ |
||
| 浓度(mol/L) |
0.12 |
0.2 |
0.9 |
1 |
1 |
| 电离度 |
0.25 |
0.2 |
0.1 |
0.3 |
0.5 |
| 电离常数 |
K1 |
K2 |
K3 |
K4 |
K5 |
A.在相同温度,从HX的数据可以说明:弱电解质溶液,浓度越低,电离度越大,且K1>K2>K3=0.01
B.室温时,若在NaZ溶液中加水,则c(Z-)/ [c(HZ)• c(OH-)]的比值变小,若加少量盐酸,则比值变大
C.等物质的量的NaX、NaY和NaZ的混合,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-)
D.在相同温度下,K5>K4>K3
下列有关说法正确的是()
| A. |
反应 |
| B. |
电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
| C. |
|
| D. |
|
下列对于溶液中的问题叙述正确的是( )
| A.向冰醋酸中加水至配成醋酸稀溶液的过程H+的浓度逐渐减小 |
| B.在稀溶液中:H+(aq) + OH-(aq) = H2O(l); △H=-57.3kJ/mol,则含1 mol HClO的稀溶液和含1 mol KOH的稀溶液完全反应放出的热量等于57.3 kJ |
| C.常温时,pH=2的CH3COOH溶液和HCl溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)相等 |
| D.常温下,将稀NaOH溶液与CH3COOH溶液混合,可能出现pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)的情况 |
25℃,在20 mL 0.1mol/L 氨水溶液中逐滴加入0.2mol/L HCl溶液(如图),下列说法正确的是
A.在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl—)>c(OH—)>c(H+)
B.在C点,c<10,且有c(NH4+)=c(Cl—)=c(OH-)=c(H+)
C.若25℃ 0.1mol/L 氨水电离度为1.33%,则b<a<12
D.在D点:2c(NH4+)+2c(NH3·H2O)=c(Cl—)
常温下有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和Na2SO4溶液中的一种。已知A、B溶液中水的电离程度相同,A、C溶液的pH相同。下列说法中不正确的是:( )
A.D溶液的pH=7
B.四种溶液相比,C溶液中水的电离程度最大
C.A与C等体积混合后,溶液中有c(Cl-)>c(NH4+) >c(H+) >c(OH-)
D.B与D等体积混合后,溶液中有c(OH-)=c(CH3COOH)+c(H+)
现有常温下的四份溶液:①pH=2的CH3COOH溶液;②pH=2的稀HCl;③0.01mol/L氨水;
④0.01mol/L NaOH溶液。下列说法正确的是
| A.将四份溶液稀释相同倍数后,溶液的pH:③<④,②<① |
| B.若将②、③等体积混合,则混合液的PH为7 |
| C.四份溶液中水的电离程度由大到小的顺序为:③>①=②=④ |
| D.若在10mL①中加入④至PH刚好等于7,则C(Na+)= C(CHCOO-),混合溶液总体积< 20mL(假设混和溶液体积为酸和碱溶液体积之和) |
下列说法正确的是:
| A.已知某温度下纯水中的c(H+)=2×l0-7mol.L-1,据此无法求出水中c(OH-) |
| B.已知MgCO3的KSP=6.82×l0-6,则在含有固体MgCO3的MgCl2、Na2CO3溶液中,都有c(Mg2+) =c(CO32-),且c(Mg2+)·c(CO32-) = 6.82×10-6 mol2.L-2 |
C.常温下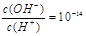 的溶液中存在Al3+、NH4+、Cl-、NO3- 的溶液中存在Al3+、NH4+、Cl-、NO3- |
| D.已知: |
| 共价键 |
C—C |
C=C |
C—H |
H—H |
| 键能/kJ·mol-1 |
348 |
610 |
413 |
436 |
由上表数据可以计算出反应 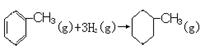 的焓变
的焓变
下列叙述正确的是( )
| A.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| B.c(H+)=c(OH-)=1×10-6mol/L溶液一定呈中性 |
C.pH=5的H2SO4的溶液稀释500倍以后,溶液中的c(H+):c(SO )=2:1 )=2:1 |
| D.0.1 mol·L-1 CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
下列关于电解质溶液的叙述正确的是
| A.常温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大 |
| B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Clˉ)>c(NH4+)>c(H+)=c(OHˉ) |
| C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D.将pH = 4的盐酸稀释后,溶液中所有离子的浓度均降低 |
下列溶液或浊液中,关于离子浓度的说法正确的是
| A.一定浓度的氨水加水稀释的过程中,c(NH4+)/ c(NH3·H2O)的比值减小 |
| B.浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-) > c(HCO3-),且2c(Na+)=3[c(CO32-)+c(HCO3-)] |
| C.0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1 NaOH溶液等体积混合后:c(CH3COO-) + 2c(OH-) = c(CH3COOH) + 2c(H+) |
| D.常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+) |
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.1L 1mol/L醋酸溶液中含有的离子总数为2NA |
| B.25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA |
| C.100mL 1mol∙L-1的Na2CO3溶液中CO32-、HCO3-和H2CO3总数为0.1NA |
| D.0.1L 3mol·L-1的FeCl3溶液中含有的Fe3+数目为0.3 NA |
下列溶液中有关物质的量浓度关系不正确的是
A.pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH) < c(NaHCO3) <c(CH3COONa)
B.已知25℃时Ksp (AgCl)=1.8×10-10,则在0.3mol·L-1NaCl溶液中,Ag+的物质的量浓度最大可达到6. 0×10-10mol·L-1
C.25℃时,0.1mol·L-1Na2CO3溶液中水电离出来的c(OH-)大于0.1mol·L-1NaOH溶液中水电离出来的c(OH-)
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有c(HA-) >c(H+)>c(H2A)>c(A2-)
常温下,0.1mol·L-1某一元酸(HA)溶液pH = 3,下列叙述正确的是( )
①该溶液中由水电离出的c(H+)=1×10-3 mol·L-1
②用pH=3的HA溶液与pH=4的HCl溶液分别中和等浓度等体积的氢氧化钠溶液所耗去酸液的体积分别为V1和V2,其关系为10V1<V2
③pH=3的HA溶液与pH=11的NaOH溶液等体积混合后所得溶液中c(Na+)=c(A-)+c(HA)
④0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液中 2c(H+)+c(HA)=c(A-)+2c(OH-)
A .① B .②③ C.②④ D.③④
硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l)  [B(OH)4] –(aq)+H+(aq)。 下列说法一定正确的是
[B(OH)4] –(aq)+H+(aq)。 下列说法一定正确的是
| 化学式 |
电离常数(298K) |
| 硼酸 |
K=5.7×10-10 |
| 碳酸 |
Ki1=4.4×10-7 Ki2=4.7×10-11 |
| 醋酸 |
K=1.75×10-5 |
A.碳酸钠溶液滴入硼酸中能观察到有气泡产生
B.醋酸滴入碳酸钠溶液中能观察到有气泡产生
C.等物质的量浓度的碳酸溶液和硼酸溶液比较, pH:前者>后者
D.等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH:前者>后者
试题篮
()