研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为。
(2)25℃,在0.10-1
溶液中,通入
气体或加入
固体以调节溶液
,溶液
与
(
-)关系如图(忽略溶液体积的变化、
的挥发)。
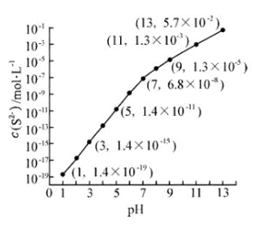
①pH=13时,溶液中的(
)+
(
-)=
-1.
②某溶液含0.020 -1
2+、0.10
-1
,当溶液
= 时,
2+开始沉淀。
[已知:(
)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如右表。
| Ka1 |
Ka2 |
|
| H2SO3 |
1.3×10-2 |
6.3×10-4 |
| H2CO3 |
4.2×10-7 |
5.6×10-11 |
①HSO3-的电离平衡常数表达式= 。
②0.10 -1
溶液中离子浓度由大到小的顺序为 。
③溶液和
溶液反应的主要离子方程式为。
下列叙述正确的是
| A.0.1 mol·L-1醋酸溶液中:c(H+)= c(CH3COO-)+c(OH-) |
| B.中和pH与体积都相同的硫酸和醋酸,消耗NaOH的量后者大于前者 |
| C.同温度同浓度的NaOH和澄清石灰水中,水的电离程度相同 |
| D.NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(OH-)>c(H+) |
室温时,0.1 mol·L-1的HA溶液的pH=3,向该溶液中逐滴加入NaOH,在滴加过程中,有关叙述正确的是
| A.原HA溶液中,c(H+)=c(OH-)+c(A-) |
| B.当滴入少量的NaOH,促进了HA的电离,溶液的pH降低 |
| C.当恰好完全中和时,溶液呈中性 |
| D.当NaOH溶液过量时,可能出现:c(A-)>c(Na+)>c(OH-)>c(H+) |
下列叙述正确的是
| A.相同温度下,中和pH=1的盐酸和醋酸各20.0mL,需要0.100 mol·L-1NaOH都是20.0mL |
| B.0.1mol·L-1Na2CO3中加入少量NaOH固体后振荡,c(Na+)和c(CO32-)都增大 |
| C.常温下,向AgCl悬浊液中加入少量NaCl固体后振荡,Ksp(AgCl)增大 |
| D.相同浓度的CH3COOH和 CH3COONa溶液等体积混合后,则:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
.下列叙述正确的是
| A.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2] < c[(NH4)2SO4] < c(NH4Cl) |
| B.向AgCl悬浊液中滴入KI溶液,有AgI沉淀生成,说明AgCl的溶解度小于AgI的溶解度 |
| C.室温下,0.2 mol•L-1盐酸与等体积0.05 mol•L-1Ba(OH)2溶液混合后,溶液的pH=1 |
| D.0.2 mol•L-1的NaHCO3溶液中c(H+)+c(H2CO3)=2c(CO32-)+c(OH-) |
常温下,实验室有0.01mol·L-1醋酸,下列叙述正确的是
| A.c (CH3COO-) + c (OH-)=" 0.01" mol·L-1 |
| B.与等体积pH = 12的氨水混合后所得溶液显碱性 |
| C.加入少量醋酸钠固体后所得溶液中c (CH3COO-)减小 |
| D.与等体积0.01 mol·L-1NaNO3溶液混合后有:c (NO3-) =" c" (CH3COO-)+c (CH3COOH) |
常温下,下列有关叙述正确的是
A.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合: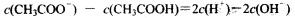 |
B.Na2CO3溶液中,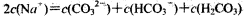 |
C.pH相等的CH3COONa、NaClO、NaHCO3三种溶液: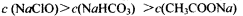 |
D.NH4Cl溶液和NaOH溶液混合所得的中性溶液中: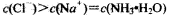 |
下列各选项中所述的两个量,前者一定大于后者的是()
| A.pH=10的NaOH和Na2CO3溶液中,水的电离程度 |
| B.物质的量浓度相等的NH4NO3溶液和氨水中NH4+的物质的量浓度 |
| C.将pH=3的盐酸和醋酸分别加水稀释成pH=5的溶液,所加水的量 |
| D.相同温度下,10mL 0.1mol·L-1的醋酸和100mL 0.01mol·L-1的醋酸中H+物质的量 |
下列溶液均为0.100mol/L,下列关系正确的是
① NH4Cl ② NH4HSO4 ③ NH4Fe(SO4)2 ④ NH3·H2O
| A.①②显酸性,③④显碱性 | B.c(NH4+):④<③<② |
| C.溶液的pH:①<②<④ | D.②溶液中:c(NH4+)+c(H+)=c(SO42-)+c(OH-) |
下列叙述正确的是
| A.电解精炼铜时,转移1mol电子,阳极上溶解的铜原子数必为0.5NA |
| B.常温下,4.4gCO2和N2O混合物中所含有的原子数为0.3×6.02×1023 |
| C.等体积0.2mol·L-1HCl溶液与0.05mol·L-1Ba(OH)2溶液混合后,溶液的pH=1 |
| D.溶液中由水电离出的c(H+)=1×10-12mol/L,SO42-、NO3-、Fe2+、Mg2+能大量共存 |
根据下表数据,下列判断正确的是
| 电离常数(25℃) |
| HF: Ki =" 3.6×10" - 4 |
| H3PO4: Ki1=" 7.5×10" -3, Ki2=" " 6.2×10 -8, Ki3=" " 2.2×10 -13 |
A. 在等浓度的NaF、NaH2PO4混合溶液中,c(Na+)+c(H+)=c(F-)+ c(H2PO4-)+ c(OH-)
B. 少量H3PO4和NaF反应的离子方程式为:H3PO4 +F-= H2PO4-+HF
C. 同温同浓度时,溶液的pH:NaF>NaH2PO4>Na2HPO4
D. 结合H+ 的能力:H2PO4-> HPO42->F-
下列说法正确的是
A.用坩埚灼烧MgCl2·6H2O的反应式 MgCl2·6H2O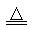 MgCl2+6H2O MgCl2+6H2O |
| B.根据下表提供的数据,等物质的量浓度的NaClO、NaHCO3混合溶液中,有c(HCO3-)>c(ClO-)>c(OH-) |
| C.常温下将pH=2的稀硫酸稀释10倍,其中各离子的物质的量浓度都变为原来的十分之一 |
| D.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,溶度积CKsp=c(Ba2+)·c(SO42-)。则加入Na2SO4可使溶液由a点变到b点;通过蒸发可以使溶液由d 点变到c 点 |
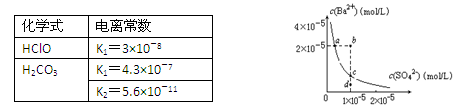
25℃时,弱酸的电离平衡常数如下表:
| 弱酸 |
CH3COOH |
HCN |
H2CO3 |
| Ka |
1.8×10-5 |
4.9×10-10 |
K1:4.3×10-7 K2:5.6×10-11 |
下列有关说法正确的是( )
A.等物质的量浓度的各溶液的pH关系为: pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol/L HCN与a mol/L NaOH溶液等体积混合后所得溶液呈中性
C.往冰醋酸中逐滴加水稀释,溶液导电能力始终保持减小
D.在Na2CO3溶液中:c(OH-)- c(H+)= c(HCO3-) + 2c(H2CO3)
已知溶液显酸性,溶液中存在以下平衡:

①

②
向0.1溶液中分别加入以下物质,下列有关说法正确的是
| A. |
加入少量金属
|
| B. |
加入少量
|
| C. |
加入少量
|
| D. |
加入氨水至中性,则
|
部分弱酸的电离平衡常数如下表:
| 弱酸 |
|||
| 电离平衡常数 (25 |
下列选项错误的是
| A. |
|
| B. |
|
| C. |
中和等体积、等 |
| D. |
等体积、等浓度的 |
试题篮
()