现有常温时pH=1的某强酸溶液10 mL,下列操作能使溶液的pH变成2的是 ( )
| A.加水稀释成100 mL |
| B.加入10 mL的水进行稀释 |
| C.加入10 mL 0.01 mol·L-1的NaOH溶液 |
| D.加入10 mL 0.01 mol·L-1的HCl溶液 |
在t℃时,将a gNH3完全溶解于水,得V mL饱和溶液,测得该溶液的密度为ρg/cm3,质量分数为ω,其中n(NH ) 为b mol。则下列叙述中错误的是 ( )
) 为b mol。则下列叙述中错误的是 ( )
A.溶液中 mol/L mol/L |
B.溶质的物质的量浓度 mol/L mol/L |
C.溶质的质量分数: |
| D.上述溶液中再加入V mL水后,所得溶液的质量分数小于0.5ω |
表示0.1mol·L-1 NaHCO3溶液中有关微粒浓度的关系式中正确的
| A.C(Na+)>C(HCO3-)>C(CO32-)>C(H+)>C(OH-) |
| B.C(Na+) = C(HCO3-) |
| C.C(Na+)+C(H+) = C(HCO3-)+2C(CO32-)+C(OH-) |
| D.C(Na+) = C(HCO3-)+C(CO32-)+C(H2CO3) |
下列叙述不正确的是( )
| A.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
| B.一定温度下,IL 1mol/L的氨水与2L 0.5mol/L的氨水中,n(NH4+)前者多 |
| C.相同体积、相同物质的量浓度的盐酸、醋酸,稀释相同倍数后,溶液的pH:盐酸<醋酸 |
| D.0.2mol/L的一元酸HX与0.1mol/L的KOH溶液等体积混合所得溶液中,一定有:a(H+)+c(K+)=c(OH-)+c(X-) |
在a LAl2(SO4)3和(NH4)2SO4的混合溶液中加入 ,恰好使溶液中的SO42—离子完全沉淀;如加入足量强碱并加热可得到c mol NH3,则原溶液中的Al3+浓度(mol/L)为( )
,恰好使溶液中的SO42—离子完全沉淀;如加入足量强碱并加热可得到c mol NH3,则原溶液中的Al3+浓度(mol/L)为( )
A. |
B. |
C. |
D. |
已知复分解反应:2 CH3COOH+Na2CO3==2CH3COONa+ H2O+CO2↑可自发进行。在常温下,测得浓度均为0.1mol/L的下列六种溶液的PH:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
| PH值 |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
表中数据提示出复分解反应的一条规律,即碱性较强的物质发生类似反应可生成碱性较弱的物质。依据该规律,请你判断下列反应不能成立的是:
| A.CO2 +H2O+ NaClO="=" NaHCO3+HClO | B.CO2 +H2O+ 2NaClO="=" Na2CO3+2HClO |
| C.CH3COOH+ NaCN="=" CH3COONa+HCN | D.CH3COOH+ NaClO="=" CH3COONa+ HClO |
已知在一密闭绝热容器中,饱和石灰水中存在平衡:Ca(OH)2(s) 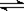 Ca2+(aq)+2OH-(aq),现向其中加入少量CaO粉末,则下列说法错误的是:
Ca2+(aq)+2OH-(aq),现向其中加入少量CaO粉末,则下列说法错误的是:
| A.析出固体的质量增加 | B.溶液的pH值不变 |
| C.溶液中的OH-数目减少 | D.溶液中的Ca2+浓度减小 |
下列说法正确的是
| A.中和物质的量浓度和体积均相同的盐酸与醋酸溶液,消耗NaOH的物质的量相等 |
| B.a mol·L-1HCN溶液与b mol·L-1NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则b一定大于a |
| C.25℃,pH均等于5的NaHSO4和NH4Cl水溶液中,水电离出c(H+)均为10-5mol·L-1 |
| D.c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-),只能满足NaHCO3溶液中的离子浓度关系。 |
现有Ph=a和pH=b的两种盐酸溶液,已知 。两种溶液等体积混合后,所得溶液的pH接近于
。两种溶液等体积混合后,所得溶液的pH接近于
A. |
B. |
C. |
D. |
酸碱完全中和时
| A.酸和碱的物质的量一定相等 |
B.酸所提供的H+与碱提供的 的物质的量相等 的物质的量相等 |
| C.酸和碱的物质的量浓度相等 |
| D.溶液一定呈中性 |
某温度下,分别在溶液中达到沉淀溶解平衡后,改变溶液
,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是

| A. |
|
| B. |
加适量
|
| C. |
|
| D. |
|
下列说法中,正确的是( )
| A.在溶液中,H+、NO3-、Fe2+、Na+一定不能大量共存 |
| B.化学反应过程中,一定有物质的变化,不一定有能量的变化 |
| C.电子工业上用30%的氯化铁溶液腐蚀敷在印刷线路板上的铜箔:Fe3+ + Cu=Fe2+ + Cu2+ |
| D.向氢氧化铁胶体中加入少量稀硫酸,因发生化学反应而产生红褐色沉淀 |
下列说法正确的是 ( )
| A.pH=5的NH4Cl溶液或醋酸中,由水电离出的c(H+)均为 10-9 mol/L |
| B.pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 |
| C.在c(H+)∶c(OH-)=1∶1012的溶液中,Na+、I-、NO3-、SO42-能大量共存 |
| D.0.1 mol/L Na2CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,溶液中 |
c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-)
某溶液中只含有Na+、H+、OH-、X-四种离子,下列说法正确的是
| A.溶液中不可能存在:c(Na+)>c (X-)>c(OH-)>c(H+) |
| B.若c(OH-)>c(H+),溶液中不可能存在:c(Na+)>c(OH-)>c(X-)>c(H+) |
| C.若溶液中c(X-) = c(Na+),则溶液一定呈中性 |
| D.若溶质为NaX、HX,则一定存在:c(X-)>c(Na+)>c(H+)>c(OH-) |
试题篮
()