水的三态的熵值的大小关系正确的是
| A.Sm(s) >Sm(l) >Sm(g) | B.Sm(l) >Sm(s) >Sm(g) |
| C.Sm(g) >Sm(l) >Sm(s) | D.Sm(g) >Sm(s) >Sm(l) |
下列叙述正确的是 ( )
| A.0.1mol/L醋酸溶液中:c(H+) = c(CH3COO- ) +c(OH- ) |
| B.中和pH与体积都相同的硫酸和醋酸,消耗NaOH的量后者大于前者 |
| C.由水电离的H+浓度为1.0×10-4mol/L的溶液,pH一定等于4 |
| D.NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3) >c(OH-)>c(H+) |
下列说法正确的是( )
A.图甲表示某温度下,  在溶液中达到沉淀溶解平衡后,改变溶液PH, 在溶液中达到沉淀溶解平衡后,改变溶液PH, 浓度的变化。由图可知 浓度的变化。由图可知 点溶液未达到饱和,因此, 点溶液未达到饱和,因此, 点的 点的 ]小于 ]小于 点。 点。 |
B.图乙表示在室温时用一定浓度的盐酸滴定V 同浓度的氨水。 同浓度的氨水。 点时溶液中 点时溶液中 = = ,且溶液中水的电离程度最大。 ,且溶液中水的电离程度最大。 |
C.图丙表示在室温时,用  溶液滴定30.00ml0.1mol/L 溶液滴定30.00ml0.1mol/L 溶液,点a所示溶液中C( 溶液,点a所示溶液中C( > > )> )> > > |
D.图丁可表示同体积同PH的某一元强酸溶液①和某一元中强酸溶液②分别与足量的锌粉发生反应生成 随时间( 随时间( )的变化情况。 )的变化情况。 |
亚硝酸(HNO2)的下列性质中,可以证明它是弱电解质的 ( )
| A.1molL-1亚硝酸溶液的c(H+)约为1×10-2mol·L-1 |
| B.亚硝酸能与水以任何比例互溶 |
| C.10mL、1mol·L-1亚硝酸恰好与10mL、1mol·L-1NaOH溶液完全反应 |
| D.亚硝酸溶液的导电性比强酸溶液的弱 |
有关电解质的下列叙述正确的是 ( )
| A.离子化合物熔融状态时都导电,因此离子化合物都是电解质 |
| B.共价化合物熔融状态时都不导电,因此共价化合物都是非电解质 |
| C.易溶于水的化合物都是强电解质 |
| D.强电解质溶液的导电能力一定强 |
现有A、B、C、D四种溶液,它们分别是AlCl3溶液、盐酸、氨水、Na2SO4溶液中的一种,已知A、B 溶液中水的电离程度相同,A、C溶液的PH相同,则下列说法正确的是:( )
A.A为AlCl3溶液,C为盐酸
B.C中加入足量B反应的离子方程式为:Al3++3OH-=Al(OH)3↓
C.A、B等体积混合后,溶液中各离子浓度由大到小的顺序为:
c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D.溶液中水的电离程度:A=B<C<D
下列说法中可能正确的是 ( )
| A.标准状况下,pH=7的醋酸和醋酸钠的混合溶液中,c(CH3COO-)=c(Na+) |
| B.pH相同的NH4Cl溶液和硫酸溶液,稀释相同倍数后,硫酸溶液的pH小 |
| C.Ba(NO3)2溶液可以鉴别SO2气体和CO2气体 |
| D.向足量饱和石灰水中加入0.56 gCaO,可析出0.74 gCa(OH)2固体 |
下图为Na2SO4的溶解度曲线,已知硫酸钠晶体(Na2SO4·10H2O)在温度为T3 K 时开始分解为无水硫酸钠。现有142 g温度为T2 K的饱和硫酸钠溶液,当温度降为T1 K或升为T4 K(T4>T3)时析出晶体的质量相等,则温度为T4 K时Na2SO4的溶解度为
| A.小于40g | B.等于40g | C.等于42g | D.大于42g |
将1mol·L-1H2SO4溶液100mL与质量分数为10%的NaOH溶液50g混合均匀后,滴入甲基橙指示剂,此时溶液的颜色是
| A.浅紫色 | B.黄色 | C.红色 | D.无色 |
下列化学原理表述正确的是
| A.氢硫酸溶液加水稀释,电离程度增大,H+浓度增大; |
| B.Na2CO3溶液中满足:c(Na+)=2c( CO32-)+2 c( HCO3-)+ 2c (H2CO3) |
C.NaHCO3溶液不显中性的原因:HCO3-+H2O CO32-+H3O+ CO32-+H3O+ |
| D.同体积同pH的盐酸和醋酸,与足量的锌反应,盐酸的反应速率快,生成H2的物质的量多; |
从下列事实所引出的相应结论,正确的是
| 选项 |
实验事实 |
结论 |
| A |
等体积pH同为3的酸HA和酸HB与足量Zn反应,酸HA放出氢气多 |
酸性:HA > HB |
| B |
Na2SO4溶液的pH小于Na2CO3溶液的pH |
非金属性:S > C |
| C |
电解同浓度的A2+和B2+硝酸盐的混合溶液,A先析出 |
金属性:A > B |
| D |
由M、N与稀硫酸构成的原电池中,M上产生大量气泡 |
金属性:M > N |
将质量分数为0.052(5.2%)的NaOH溶液1 L(密度为1.06 g/cm3),用铂作电极电解,当溶液中NaOH的质量分数改变了0.010(1.0%)时停止电解,此时溶液中符合下表关系的是( )
| |
NaOH的 质量分数 |
阳极析出 物质的质量/g |
阴极析出物 质的质量/g |
| A |
0.062(6.2%) |
19 |
152 |
| B |
0.062(6.2%) |
152 |
19 |
| C |
0.042(4.2%) |
1.2 |
9.4 |
| D |
0.042(4.2%) |
9.4 |
1.2 |
某学生用 和
和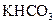 组成的混合物与盐酸反应并进行实验,测得如下数据(盐酸的物质的量浓度相等)
组成的混合物与盐酸反应并进行实验,测得如下数据(盐酸的物质的量浓度相等)
| |
50mL盐酸 |
50mL盐酸 |
50mL盐酸 |
| m(混合物) |
9.2g |
15.7g |
27.6g |
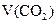 (标准状况) (标准状况) |
2.24L |
3.36L |
3.36L |
则下列分析推理中不正确的是( )
A.盐酸的物质的量浓度为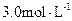 |
B.根据表中数据能计算出混合物中 的质量分数 的质量分数 |
| C.加入混合物9.2g的一组实验中盐酸过量 |
| D.15.7g混合物恰好与盐酸完全反应 |
pH=3的两种酸溶液A、B,取等体积酸分别与足量的锌反应,酸A比酸B产生的氢气的量多.下列说法正确的是 ( )
A.A是强酸、B一定是弱酸 B.A是弱酸、B一定是强酸
C.A是强酸、B是强酸 D.A酸性一定比B酸性弱
试题篮
()