用0.1mol·L—1的盐酸滴定0.1mol·L—1的氨水,在滴定过程中不可能出现的结果是
| A.c(NH4+)>c(Cl-),c(OH-)>c(H+) |
| B.c(NH4+)=c(Cl-),c(OH-)=c(H+) |
| C.c(Cl-)>c(NH4+),c(OH-)>c(H+) |
| D.c(Cl-)>c(NH4+),c(H+)>c(OH-) |
下列说法正确的是 ( )
| A.90℃时,纯水的pH等于7 |
| B.已知一种c (H+)=1×10-3mol/L的酸和一种c (OH-)=1×10-3mol/L碱溶液以等体积混合后,溶液呈酸性,其原因是浓的弱酸和稀碱反应所致 |
| C.配制FeCl3溶液,为了抑制水解,常加稀硫酸 |
| D.在Na2S溶液中,离子浓度的关系是:c (Na+)>c (S2-)>c (HS-)>c (OH-)>c (H+) |
下列说法正确的是 ( )
| A.增大反应物浓度,可增大单位体积内活化分子的数目,从而使反应速率增大 |
| B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 |
| C.pH值为7的溶液一定呈中性 |
| D.pH=3的盐酸和pH=11的氨水溶液,溶质的浓度和导电能力均相同 |
下列说法正确的是
| A.向0.1 mol/L Na2CO3溶液中滴加酚酞,溶液变红色 |
| B.Al3+、NO、Cl-、CO、Na+可大量共存于pH=2的溶液中 |
| C.乙醇和乙酸都能溶于水,都是电解质 |
| D.分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同 |
常温离子液体(又称常温熔融盐),是当前化学研究的热点和前沿。1914年报道的第一种离子液体硝酸乙基铵[(C2H5NH3)NO3]的熔点为12℃。已知C2H5NH2的化学性质与NH3相似,下列有关硝酸乙基铵的说法中,正确的是
| A.该离子液体可以作为电池的电解质 |
| B.硝酸乙基铵水溶液呈碱性 |
| C.(C2H5NH3)NO3能与NaOH反应产生NH3 |
| D.硝酸乙基铵水解的离子方程式可表示为:C2H5NH3++H2O=C2H5NH2+H3O+ |
下列叙述中,不正确的是
| A.0.1 mol?L-1 CH3COOH溶液加水稀释,n(H+)增大 |
| B.0.2 mol?L-1盐酸与等体积0.05 mol?L-1 Ba(OH)2溶液混合后,溶液pH为1 |
| C.向含等浓度的KCl和KI的混合溶液,滴加少量AgNO3溶液生成黄色沉淀,说明同温度下Ksp(AgCl)大于Ksp(AgI) |
| D.若NH4HCO3溶液、NH4HSO4溶液和NH4NO3溶液中c(NH4+)相等,则 |
c(NH4HSO4) < c(NH4NO3) < c(NH4HCO3)
下列反应的离子方程式正确的是
| A.物质的量浓度相等的碳酸氢钡溶液和氢氧化钠溶液等体积混合 Ba2+ + 2HCO3- + 2OH- = BaCO3↓+CO32- + 2H2O |
|
| B.NaHSO4溶液中滴加入Ba(OH)2溶液至中性 电解 |
C.以石墨作电极电解氯化镁溶液:2Cl-+2H2O ="==" 2OH-+H2↑+Cl2↑ |
D.碳酸氢钠溶液加入氯化铝溶液 3HCO3-+Al3+ 3CO2+Al(OH)3 3CO2+Al(OH)3 |
已知:弱酸HCN(aq)与NaOH(aq)反应的△H = +12.1kJ/mol; HCl(aq)与NaOH(aq)反应的
△H =-55.6kJ/mol 。则HCN在水溶液中电离的△H等于:
| A.-67.7Kj/mol | B.+67.7 kJ/mol | C.+43.5 kJ/mol | D.-43.5kJ/mol |
有体积相同、pH相等的烧碱溶液和氨水,下列叙述中正确的是
| A.两溶液溶质物质的量浓度相同 |
| B.用同浓度的盐酸中和时,消耗盐酸的体积相同 |
| C.两溶液中OH-离子浓度相同 |
| D.加入等体积的水稀释后,它们的pH仍相等 |
纯净的氯化钠是不潮解的,但粗盐很容易潮解,这主要是因为其中含有杂质MgCl2的缘故。为得到纯净的氯化钠,有人设计了一个实验:把买来的粗盐放入纯氯化钠饱和溶液一段时间,过滤,洗涤,可得纯净的氯化钠晶体。则下列说法中,正确的是
| A.设计实验的根据是NaCl的溶解平衡 |
| B.设计实验的根据是MgCl2比NaCl易溶于水 |
| C.在整个过程中NaCl饱和溶液浓度会变大(温度不变) |
| D.粗盐的晶粒大一些有利于提纯 |
在盛有1mL1mol·L-1AlCl3溶液的试管中加入2 mL10%的NH4F溶液,再加入1mL3mol·L-1氨水,没有生成白色沉淀,其原因是( )
| A.溶液的碱性不够强 | B.Al3+不与氨水反应 |
| C.生成的Al(OH)3溶解了 | D.Al3+几乎都与F-结合生成了新的物质 |
请回答下列问题:
(1)①现有0.1mol/L的纯碱溶液,若用pH试纸测定溶液的pH,其正确的操作是 。
②纯碱溶液呈碱性的原因是(用离子方程式表示) 。
(2)①已知4.4g丙烷完全燃烧生成二氧化碳气体和液态水,并放出222.0kJ的热量,请写出反应的热化学方程式: 。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ/mol,实验测得甲烷与丙烷的混合气体1mol完全燃烧生成液态水和二氧化碳气体时,放热1776.7kJ,则混合气体中甲烷与丙烷的体积比为 。
pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH
与溶液体积(V)的关系如图所示,下列结论正确的是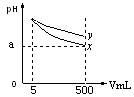
| A.相同温度下,x的的电离平衡常数小于y |
| B.若x、y是一元碱,等物质的量浓度的盐酸盐溶液,y的pH大 |
| C.若x、y都是弱碱,则a的值一定大于9 |
| D.完全中和x,y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y) |
下列说法错误的是
| A.将pH=4的醋酸稀释后,溶液中所有离子的浓度均减小 |
| B.pH=11的某溶液中,水的电离可能促进也可能是抑制 |
| C.改变条件使醋酸的电离平衡向右移动,醋酸的电离度可能增大也可能减小 |
| D.改变条件使醋酸钠溶液中的醋酸根离子浓度增大,溶液的pH可能减小也可能增大 |
试题篮
()