关于浓度均为0.1 mol·L-1的三种溶液:①CH3COOH、②NaOH、③CH3COONa溶液,下列说法不正确的是
| A.c(CH3COO-):③>① |
| B.水电离出的c(OH-):②>① |
| C.①和②等体积混合后的溶液:c(OH-)=c(H+)+c(CH3COOH) |
| D.①和③无论以何种比例混合,混合后的溶液:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
.室温下,将1.00mol·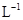 盐酸滴人20.00mL1.00
盐酸滴人20.00mL1.00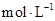 氨水中,溶液pH随加人盐酸体积变化曲线如图所示。下列有关说法正确的是
氨水中,溶液pH随加人盐酸体积变化曲线如图所示。下列有关说法正确的是
D.a点:pH="14"
B.b点: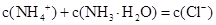
C.c点,水电离出的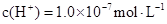
D.c点后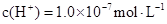 溶液中离子浓度大小关系一定为:
溶液中离子浓度大小关系一定为:
下列叙述正确的是
| A.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中, 溶质浓度大小关系是:c[(NH4)2Fe(SO4)2] < c[(NH4)2SO4] < c(NH4Cl) |
| B.向AgCl悬浊液中滴入KI溶液,有AgI沉淀生成,说明AgCl的溶解度小于AgI 的溶解度 |
| C.0.2 mol?L-1盐酸与等体积0.05 mol?L-1Ba(OH)2溶液混合后,溶液的pH=1 |
| D.0.2 mol?L-1的NaHCO3溶液中c(H+)+c(H2CO3)=2c(CO32-)+c(OH-) |
室温下向10mLpH=3的醋酸溶液中加水稀释后,下列说法正确的是
| A.溶液中导电粒子的数目减少 |
| B.溶液中c(OH-)亦增大 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10mLpH=11的NaOH溶液,混合液的pH=7 |
将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后,溶液显酸性,则溶液有关微粒的浓度关系正确的是
A c (Ac-)>c (Cl-)>c (H+)>c (HAc)
B c (Ac-)>c (Cl-)>c (HAc)>c(H+)
C c (Ac-)=c (Cl+)>c (H+)>c (HAc)
D c (Na+)+c (H+)=c (Ac-)+c (OH-)
在0.10mol·L-1NH3·H2O溶液中,加入少量NH4Cl晶体后,引起的变化是
| A.NH3·H2O的电离程度减小 |
| B.NH3·H2O的电离常数增大 |
| C.溶液的导电能力不变 |
| D.溶液的pH增大 |
常温下,下列溶液中c(H+)最小的是
| A.c(OH-)=1×10-11mol·L-1 | B.pH=3的CH3COOH溶液 |
| C.pH=4的H2SO4溶液 | D.c(H+)=1×10-3mol·L-1 |
下列有关沉淀溶解平衡的说法中,正确的是( )
A. Ksp(AB2)小于Ksp(CD),说明AB2的溶解度小于CD的溶解度
B.在氯化银的沉淀溶解平衡体系中加入蒸馏水,氯化银的Ksp增大
C.在碳酸钙的沉淀溶解平衡体系中加入稀盐酸,沉淀溶解平衡不移动
D.向氯化银沉淀溶解平衡体系中加人碘化钾固体,氯化银沉淀可转化为碘化银沉淀
下列说法正确的是
| A.将氯化铝和硫酸铝溶液蒸干灼烧后均得到氧化铝 |
| B.向足量饱和石灰水中加入0.56 g CaO,可得固体0.74 g |
| C.由碱金属元素形成的单质熔点随原子序数的递增逐渐降低 |
| D.向稀醋酸中加入醋酸钠固体,溶液pH升高的主要原因是醋酸钠水解呈碱性 |
下列表述正确的是
| A.NaHCO3溶液中:c(H+) + c(H2CO3) =c(OH-) |
| B.中和等体积、等pH相同的盐酸和CH3COOH溶液所消耗的NaOH物质的量相同 |
| C.pH=2的HA溶液与pH=12的MOH溶液以任意比混合后,所得溶液中: c(H+) + c(M+) =c(OH-) + c(A-) |
| D.在水电离出的H+浓度为1×10-12 mol/L的溶液中,K+、Mg2+、NO3-、I-一定能大量共存 |
向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为
| A.减小、增大、减小 | B.增大、减小、减小 |
| C.减小、增大、增大 | D.增大、减小、增大 |
将pH=3的盐酸a L分别与下列三种溶液混合后,混合液均呈中性:
①1×10-3 mol·L-1的氨水b L
②c(OH-)=1×10-3 mol·L-1的氨水c L
③c(OH-)=1×10-3 mol·L-1的Ba(OH)2溶液d L
其中a、b、c、d的关系正确的是
| A.b>a=d>c | B.a=b>c>d |
| C.a=b>d>c | D.c>a=d>b |
下列电离方程式中,正确的是
| A.Ba(OH)2 =Ba2++ (OH)- | B.FeCl3=Fe2++3Cl- |
| C.H2SO4 =H2++SO42- | D.Al2(SO4)3=2Al3++3SO42- |
下列化学原理表述正确的是 ( )
| A.氢硫酸溶液加水稀释,电离程度增大,H+浓度增大 |
| B.同体积同pH的盐酸和醋酸与足量的锌反应,醋酸的反应速率快,生成H2的物质的量多 |
C.NaHCO3溶液不显中性的原因:HCO3-+H2O CO32-+H3O+ CO32-+H3O+ |
| D.Na2CO3溶液中满足:2c(Na+)=c(CO32-)+ c(HCO3-)+ c(H2CO3) |
试题篮
()