已知达到电离平衡的0.1mol/L的醋酸溶液中,为了促进醋酸的电离,同时使溶液的pH降低,应采取的措施是
| A.加入一定量的水 | B.加热溶液 | C.加入少量盐酸 | D.加入冰醋酸 |
下列化学原理表述正确的是 ( )
| A.氢硫酸溶液加水稀释,电离程度增大,H+浓度增大 |
| B.同体积同pH的盐酸和醋酸与足量的锌反应,醋酸的反应速率快,生成H2的物质的量多 |
C.NaHCO3溶液不显中性的原因:HCO3-+H2O CO32-+H3O+ CO32-+H3O+ |
| D.Na2CO3溶液中满足:2c(Na+)=c(CO32-)+ c(HCO3-)+ c(H2CO3) |
将足量的BaCO3分别加入:
①30mL水 ②10mL0.2mol/LNa2CO3溶液
③50m L0.01mol/LBaCl2溶液 ④100mL0.01mol/LHCl溶液
中溶解至溶液饱和,请确定各溶液中Ba2+的浓度由大到小的顺序为( )
| A.①②③④ | B.③④①② | C.④①③② | D.②①④③ |
下列说法正确的是( )
| A.25℃时NH4Cl溶液的KW大于100℃时NaCl溶液的KW |
| B.SO2通入碘水中,反应的离子方程式为SO2 + I2 + 2H2O = SO42- + 2I- + 4H+ |
| C.加入铝粉能产生H2的溶液中,可能存在大量的Na+、HCO3-、AlO2— 、NO3— |
| D.100℃时,将 pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 |
下列有关实验原理或实验操作正确的是 ( )
| A.用pH试纸测定氯水的pH |
| B.过滤时为了加快过滤速度,可以用玻璃棒小心搅拌 |
C.选择合适的试剂,用右图所示装置可分别制取少量CO2和O2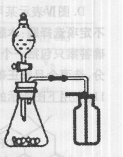 |
| D.室温下向苯和苯酚的混合溶液中加入浓溴水,充分反应后过滤,可除去苯中少量苯酚 |
下列说法正确的是( )
| A.某物质的溶解性为难溶,则该物质不溶于水 | B.不溶于水的物质溶解度为0 |
| C.绝对不溶解的物质是不存在的 | D.某离子被沉淀完全是指该离子在溶液中的浓度为0 |
化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是( )
A.根据图①可判断可逆反应A2(g)+3B2(g)  2AB3(g)的△H>O 2AB3(g)的△H>O |
B.图②表示压强对可逆反应2A(g)+2B(g)  3C(g)+D(s)的影响,乙曲线表示的压强大 3C(g)+D(s)的影响,乙曲线表示的压强大 |
| C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
| D.室温时,CaC03在水中的沉淀溶解平衡曲线如图④所示,c点时有CaC03生成 |
下列各选项中所述的两个量,前者一定大于后者的是( )
A.1 L 0.3 mol/L CH3COOH溶液和3 L 0.1 mol/L CH3COOH溶液中的H+数 0.1 mol/L CH3COOH溶液中的H+数 |
| B.pH=1的CH3COOH溶液和盐酸的物质的量浓度 |
| C.pH=12的氨水和NaOH溶液的导电能力 |
| D.pH相同的等体积的盐酸和醋酸溶液分别与足量锌粒反应产生的气体体积 |
下列说法正确的是( )
| A.向0.1 mol/L Na2CO3溶液中滴加酚酞,溶液变红色 |
| B.Al3+、NO3-、Cl-、CO32-、Na+可大量共存于pH=2的溶液中 |
| C.乙醇和乙酸都能溶于水,都是电解质 |
| D.分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同 |
室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )
| A.溶液中导电粒子的数目增加,导电性增强 |
| B.醋酸的电离程度增大,c(H+)亦增大 |
| C.再加入10mL pH="11" NaOH溶液,混合液pH=7 |
D.溶液中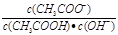 不变 不变 |
将一元碱BOH的溶液与一元酸HA的溶液等体积混合,若所得溶液呈碱性,下列有关判断正确的是
| A.若混合前酸、碱pH之和等于14,则HA肯定是弱酸 |
| B.若混合前酸、碱物质的量浓度相同,则HA肯定是弱酸 |
| C.溶液中水的电离程度:混合溶液>纯水>BOH溶液 |
| D.混合溶液中离子浓度一定满足:c(B+)>c(A—)>c(H+)>c(OH—) |
下列叙述错误的是
| A.从FeCl3固体出发配制其溶液时,应先将FeCl3固体溶解在一定浓度的盐酸溶液中,然后再稀释到所需要的浓度 |
B.Al3+的水解方程式为 Al3+ + 3H2O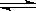 Al(OH)3 + 3H+ Al(OH)3 + 3H+ |
| C.NaHSO4在水溶液中的电离方程式为 NaHSO4 =" Na+" + H+ + SO42- |
| D.H2CO3的电离方程式为 H2CO3 =" H+" + HCO3- |
用惰性电极电解下列溶液一段时间后,停止电解,向溶液中加入一定质量的另一种物质(括号内),可能使溶液完全复原的是
| A.CuCl2 (CuO) | B.NaOH (NaOH) |
| C.CuSO4 (Cu(OH)2 ) | D.NaCl (Cl2) |
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
| A.V(NaOH)= 0时,c(H+)="1" × 10-2 mol/L |
| B.V(NaOH)< 10 mL时,不可能存在c(Na+)=" 2" c(C2O42-)+ c(HC2O4-) |
| C.V(NaOH)=" 10" mL时,c(H+)="1" × 10-7mol/L |
| D.V(NaOH)> 10 mL时,c(Na+)> c(C2O42-)>c(HC2O4-) |
试题篮
()