20ml 1mol/LCH3COOH溶液跟40ml 0.5mol/LNaOH溶液相混合,所得溶液中离子浓度由大到小的顺序是( )
| A.c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B.c(Na+)=c(CH3COO-),c(CH3COO-)>c(OH-)>c(H+) |
| C.c(Na+)>c(OH-)>c(CH3COO-)>c(H+)>c(CH3COO-) |
| D.c(Na+)>c(OH-)>c(H+)>c(CH3COO-) |
在氯化铵溶液中,下列关系式正确的是 ( )
| A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| B.c(NH4+)> c(Cl-)>c(H+)>c(OH-) |
| C.c(Cl-)=c(NH4+)>c(H+)=c(OH-) |
| D.c(NH4+)= c(Cl-)>c(H+)>c(OH-) |
向15mL 0.1mol·L-1KOH溶液中逐滴加入0.2 mol·L-1甲酸(HCOOH,一元弱酸)溶液,溶液pH和加入的甲酸的体积关系曲线如右图所示,有关粒子浓度大小关系正确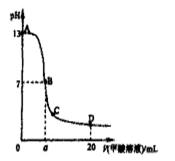
A.在A、B间任意一点c(K+) > c(HCOO-) > c(OH-) > c(H+)
B.在B点:c(K+) = c(HCOO-) > c(OH-) = c(H+),且a=7.5
C.在C点:c(HCOO-) > c(K+) > c(OH-) > c(H+)
D.在D点:c(HCOO-) + c(HCOOH) > 2c(K+)
下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A.0.1mol/L的(CH3COO)2Ba溶液中:C(Ba2+)+C(H+)=2C(CH3COO-)+C(OH-) |
| B.常温下,向醋酸钠溶液中滴加稀盐酸,至溶液呈中性;则混合液中: C(Cl-)﹥C(Na+)﹥C(CH3COOH) |
| C.相同条件下,物质的量浓度相同的①氯化铵溶液;②醋酸溶液;③稀盐酸;溶液中由水电离出来的C(H+):①﹥③﹥② |
| D.PH相等的:①NH4HSO4溶液;②NH4Cl溶液;③(NH4)2SO4溶液,溶液中 |
C(NH4+):②=③﹥①
向0.1mol/L的NaOH溶液中慢慢滴加同浓度的醋酸溶液,离子浓度之间的关系不可能出
现的是
| A.c(CH3COO-)>c(H+) = c(Na+)>c(OH-) | B.c(Na+)>c(OH-) >c(CH3COO-)>c(H+) |
| C.c(OH-)>c(Na+)>c(H+)>c(CH3COO-) | D.c(Na+) >c(CH3COO-)>c(OH-) >c(H+) |
将足量的CO2慢慢通入一定体积的NaOH溶液中,溶液的pH随CO2的体积(已经折算成标准状况)的变化曲线如图所示(不考虑过量的CO2在水中的溶解和反应过程中溶液体积的变化),则下列说法不正确的是( )
| A.NaOH溶液的物质的量浓度为0.1mol/L |
| B.NaOH溶液的体积为2L |
| C.M点离子浓度的大小关系满足c(HCO3-)>c(CO32-) |
| D.M、N点对应的纵坐标均大于7 |
下列说法正确的是( )
| A.pH=2与pH=1的硝酸中c(H+)之比为1:10 |
| B.Na2CO3溶液中c(Na+)与c(CO32-)之比为2:1 |
| C.0.2 mol?L-1与0.1mol/L醋酸中c (H+)之比为2:1 |
| D.NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为3:1 |
在CH3COOH H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取的措施是
H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取的措施是
| A.加入NaOH | B.加入盐酸 |
| C.加水 | D.升高温度 |
将a moL/L的Na2CO3溶液与b mol/L的NaHCO3溶液等体积混合,所得溶液中粒子浓度间的关系及相关判断不正确的是( )
| A.c(Na+)+c(H+)>c(CO32-)+c(HCO3-)+c(OH-) |
| B.c(Na+)>c(CO32-)+c(HCO3-)+c(H2CO3) |
| C.若c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),则一定a<b |
| D.若c(CO32-)+2c(OH-)=2c(H+)+c(HCO3-)+3c(H2CO3),则可确定a=b |
已知25℃时有关
弱酸的电离平衡常数:则下列有关说法正确的是
| 弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25℃ ) |
1.8×l0-5 |
4.9×l0-10 |
K1=4.3×l0-7 K2=5.6×l0 -11 |
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L—1 HCN溶液与b mol·L—1 NaOH溶液等体积混合后,所得溶液中
c(CN-)>c(Na+),则a一定大于b
C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+ c(H+)=c(OH-)+ c(HCO3-) +2c(CO32-)
在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH  CH3COO-+H+ 对于该平衡,下列叙述正确的是( )
CH3COO-+H+ 对于该平衡,下列叙述正确的是( )
| A.加入少量NaOH固体,平衡向逆反应方向移动 |
| B.升高温度,平衡向正反应方向移动 |
| C.加入水,CH3COOH的电离程度变大,溶液中c(H+)一定增大 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
下列说法正确的是:
| A.将AlCl3溶液、Na2SO3溶液蒸干并灼烧可分别得到Al2O3、Na2SO3 |
| B.在溶液的稀释过程中,离子浓度有的可能增大,有的可能减小,有的可能不变 |
| C.0.1 mol/L CH3COOH溶液在稀释过程中将变小 |
| D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
向ZnSO4溶液中加入Na2S溶液时,得到白色沉淀,然后向白色沉淀中滴加CuSO4溶液,发现沉淀变为黑色,则下列说法不正确的是( )
| A.白色沉淀为ZnS,黑色沉淀为CuS | B.上述现象说明ZnS的Ksp小于CuS的Ksp |
| C.利用该原理可实现一种沉淀转化为更难溶的沉淀 | D.该过程破坏了ZnS的溶解平衡 |
下列图像能正确反映所对应实验的是 
| A.①为向pH=13的NaOH溶液中不断加水 |
B. ②为向MnO2中加入一定量的H2O2溶液 ②为向MnO2中加入一定量的H2O2溶液 |
| C.③为向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 |
| D.④为将氨气通入醋酸溶液中 |
某学习小组根据化学知识和下表的数据,设计了表中的实验,以验证酸性:盐酸>碳酸>苯酚>碳酸氢根离子,其中不合理的是 ( )
| 物质 |
电离常数 |
和溶解度(25℃) |
| C6H5OH |
K=1.28×10-10 |
S = 9.3g/100g水 |
| H2CO3 |
K1 =4.3×10-7 |
|
| K2 =5.6×10-11 |
|
| |
组别 |
操作 |
判断依据 |
| A |
盐酸和碳酸 |
往碳酸钙固体中滴加盐酸 |
观察有无气体产生 |
| B |
碳酸与苯酚 |
往苯酚钠饱和溶液中,通入足量CO2 |
观察溶液是否变浑浊 |
| C |
碳酸与苯酚 |
配制同物质的量浓度的碳酸钠溶液和苯酚钠溶液 |
比较溶液的pH |
| D |
HCO3-与苯酚 |
在苯酚悬浊液中,加入过量的 Na2CO3溶液 |
观察悬浊液是否变澄清 |
试题篮
()