为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
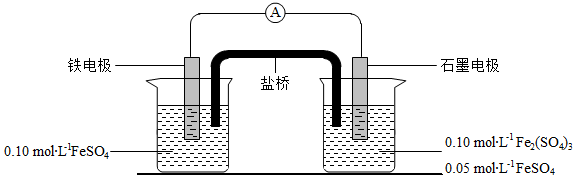
回答下列问题:
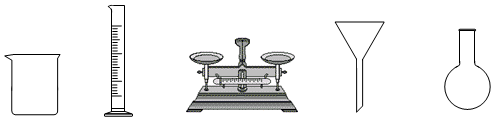
(1)由FeSO 4•7H 2O固体配制0.10mol•L ﹣ 1FeSO 4溶液,需要的仪器有药匙、玻璃棒、 (从下列图中选择,写出名称)。
(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u ∞)应尽可能地相近。根据下表数据,盐桥中应选择 作为电解质。
| 阳离子 |
u ∞×10 8/(m 2•s ﹣ 1•V ﹣ 1) |
阴离子 |
u ∞×10 8/(m 2•s ﹣ 1•V ﹣ 1) |
| Li + |
4.07 |
HCO 3 ﹣ |
4.61 |
| Na + |
5.19 |
NO 3 ﹣ |
7.40 |
| Ca 2+ |
6.59 |
Cl ﹣ |
7.91 |
| K + |
7.62 |
SO 4 2 ﹣ |
8.27 |
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入 电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe 2+)增加了0.02mol•L ﹣ 1.石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe 2+)= 。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为 ,铁电极反应式为 。因此,验证了Fe 2+氧化性小于 ,还原性小于 。
(6)实验前需要对铁电极表面活化。在FeSO 4溶液中加入几滴Fe 2(SO 4) 3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是 。
下列有关实验的操作正确的是( )
| |
实验 |
操作 |
| A |
配制稀硫酸 |
先将浓硫酸加入烧杯中,后倒入蒸馏水 |
| B |
排水法收集 分解产生的 |
先熄灭酒精灯,后移除导管 |
| C |
浓盐酸与 反应制备纯净 |
气体产物先通过浓硫酸,后通过饱和食盐水 |
| D |
萃取碘水中的 |
先从分液漏斗下口放出有机层,后从上口倒出水层 |
| A. | A |
B. | B |
C. | C |
D. | D |
50 ℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )。
| A.pH=4的醋酸中:c(H+)=4.0 mol·L-1 |
| B.饱和小苏打溶液中:c(Na+)=c(HCO3—) |
| C.饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) |
| D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2 mol·L-1 |
在a、b两支试管中,分别装入足量Na2CO3粉末,然后向两支试管中分别加入相同物质的量浓度、相同体积的稀盐酸和稀醋酸。填写下列空白。
(1)a、b两支试管中的现象:相同点是__________,不同点是__________________。原因是__________________。
(2)a、b两支试管中生成气体的速率开始时是a__________b,反应完毕后生成气体的总体积是a__________b,原因是__________________。
25 ℃时,x mol·L-1氢氟酸水溶液中,加入KOH固体调节溶液的pH(忽略加入固体引起的溶液体积变化),得到c(HF)、c(F-)与溶液pH的变化关系如图所示。下列说法正确的是 ( )。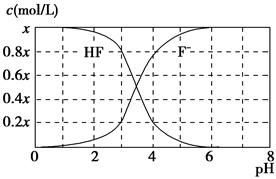
| A.当c(F-)>c(HF)时,溶液呈碱性 |
| B.当pH=2时,c(F-)<c(K+) |
| C.25 ℃时,氢氟酸的电离平衡常数为4×10-6 |
| D.当pH=5时,c(HF)+c(K+)+c(H+)-c(OH-)=x mol·L-1 |
关于浓度均为0.1mol·L-1的三种溶液:①醋酸溶液 ②NaOH溶液 ③醋酸钠溶液,下列说法不正确的是( )
| A.C(CH3COO-):③>① |
| B.水电离出的C(OH-):②>① |
| C.①和②等体积混合后的溶液:C(OH-)=C(H+)+C(CH3COOH) |
| D.①和③等体积混合后的溶液显酸性:C(CH3COO-)>C(Na+)>C(H+)>C(OH-) |
将Cu与CuO的混合物20.8g加入到50mL 18.4mol/L浓H2SO4中,加热充分反应至固体物质完全溶解,冷却后将混合液稀释至1000 mL,测得c(Cu2+)="0.3" mol/L。试计算:
(1)反应过程中放出的气体在标准状况下的体积(不考虑气体在溶液中的溶解)。
(2)溶液稀释后,c(H+)是多少?
食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6] •3H2O。
42.2g K4[Fe(CN)6] •3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。试回答下列问题: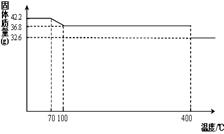
(1)试确定150℃时固体物质的化学式为_______________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为___________________________________。
(3)在25℃下,将a mol•L-1的KCN(pH>7)溶液与0.01mol•L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a_______0.01mol•L-1(填“>”、“<”或“=”)。
(4)在25℃下,KCN溶液pH=9,c(K+)-c(CN_)="_______" mol•L-1(用数字表示但不需近似计算)。
(5)已知Fe(OH)3的溶度积常数Ksp=1.1×10-38。室温时在FeCl3溶液中滴加NaOH溶液,当溶液中Fe3+沉淀完全时,控制pH应不小于 。
(提示:当某离子浓度小于10-5 mol•L-1时可以认为该离子沉淀完全了;)
(1)将0.15 mol·L-1稀硫酸V1 mL与0.1 mol·L-1 NaOH溶液V2 mL混合,所得溶液的pH为1,则V1∶V2=________。(溶液体积变化忽略不计)
(2)室温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,根据题意,回答下列问题:
①若由0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合而得,则溶液的pH________7。
②若溶液pH>7,则c(Na+)________c(A-),理由是____________________________________。
③若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是________(填选项代号)。
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7 mol·L-1 |
| B.若V1=V2,反应后溶液的pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
常温时,将a1 mL、b1 mol·L-1的CH3COOH溶液加入到a2 mL、b2 mol·L-1的NaOH溶液中,下列结论中正确的是 ( )。
| A.如果a1b1=a2b2,则混合溶液的pH=7 |
| B.如果混合液的pH=7,则混合溶液中c(CH3COO-)=c(Na+) |
| C.如果a1=a2,b1=b2,则混合溶液中c(CH3COO-)=c(Na+) |
| D.如果a1=a2,且混合溶液的pH>7,则b1<b2 |
室温时,1 L 0.15 mol·L-1的NaOH溶液充分吸收2.24 L CO2(标准状况),然后温度恢复到室温。下列有关反应后溶液的判断正确的是 ( )。
| A.pH<7 |
| B.溶质为NaHCO3 |
| C.2c(Na+)=3[c(H2CO3)+c(HCO3—)+c(CO32—)] |
| D.c(Na+)>c(CO32—)>c(HCO3—)>c(OH-)>c(H+) |
已知:氢氧化镁能溶于浓度均为3mol/L的①盐酸②NH4Cl溶液③醋酸铵溶液(中性),下列说法正确的是( )
| A.c(NH4+):③ > ② |
| B.pH:① > ② > ③ |
C.Mg(OH)2溶于②的主要原因是由于NH4+水解使溶液显酸性,导致平衡Mg(OH)2(s) Mg2+ (aq) + 2OH- (aq)向溶解方向移动 Mg2+ (aq) + 2OH- (aq)向溶解方向移动 |
| D.等体积①和③混合溶液中 c(Cl-) >c(NH4+) > c(H+) > c(CH3COO-) > c(OH-) |
常温下,下列有关溶液的pH或微粒的物质的量浓度关系的判断不正确的是( )。
A.pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,所得溶液的pH<7
B.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合溶液的pH=7,则反应后的混合溶液中:2c(R2-)+c(HR-)=c(Na+)
C.将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1 NaOH溶液等体积混合后,混合溶液的pH大于7,则反应后的混合溶液中:2c(OH-)=2c(H+)+c(HA)-c(A-)
D.某物质的溶液中由水电离出的c(H+)=1×10-a mol·L-1,若a>7,则该溶液的pH一定为14-a
下列有关说法正确的是
| A.将Al2(SO4)3溶液蒸干得到Al2(SO4)3固体 |
| B.用广泛pH试纸测得某溶液pH为11.3 |
| C.向纯水通入少量HCl气体,水的电离程度减小,Kw减小 |
| D.向0.1 mol·L-1 CH3COOH溶液中加少量水,溶液中所有离子的浓度都减小 |
根据水溶液中存在的平衡关系,判断下列说法正确的是
| A.往水中滴加少量稀硫酸,能促进水电离 |
| B.室温下,稀释0.1mol·L-1的醋酸,溶液中所有离子的浓度均降低 |
| C.往AgCl悬浊液中加入0.1mol·L-1Na2S溶液,有黑色沉淀产生 |
| D.浓度均为0.1 mol·L-1的溶液,pH由大到小排列顺序为:NaOH>Na2CO3>NaHSO4>(NH4)2SO4 |
试题篮
()