甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是
反应①:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0
CO(g)+3H2(g) ΔH>0
(1)已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=-802 kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) ΔH2=-283 kJ·mol-1
H2(g)+1/2O2(g)=H2O(g) ΔH3=-242 kJ·mol-1
则反应①的ΔH=________。
(2)其他条件相同,反应①在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CH4的转化率随反应温度的变化如图所示。

①在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是________。
②a点所代表的状态________(填“是”或“不是”)平衡状态。
③c点CH4的转化率高于b点,原因是________。
(3)CO和氢气在一定条件下可以合成甲醇,在一恒容的密闭容器中,由CO和H2合成甲醇:
CO(g)+2H2(g) CH3OH(g) ΔH
CH3OH(g) ΔH
①下列情形不能说明该反应已达到平衡状态的是_______(填序号)。
A.每消耗1 mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②某温度下,将2.0 mol CO和6.0 molH2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.25mol/L,则CO的转化率= ,此温度下的平衡常数K= (保留二位有效数字)。
③在某温度和压强下,将一定量 CO与H2充入密闭容器发生上述反应,平衡后压缩容器体积至原来的l/2,其他条件不变,对平衡体系产生的影响是 (填序号):
A.c(H2)减少; B.平衡常数K增大; C.CH3OH 的物质的量增加;
D.正反应速率加快,逆反应速率减慢; E.重新平衡c(H2)/c(CH3OH)减小
甲醇又称“木醇”,是无色有酒精气味易挥发的有毒液体。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g) CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g) CO2(g)+2H2(g) △H=Q2kJ·mol-1
CO2(g)+2H2(g) △H=Q2kJ·mol-1
②H2O(g)=H2O(l) △H= Q3kJ·mol-1,则表示甲醇的燃烧热的热化学方程式为 。
(2)工业上可用CO和H2O (g) 来合成CO2和H2,再利用⑴中反应原理合成甲醇。某温度下,将1molCO和1.5molH2O充入10L固定密闭容器中进行化学反应:CO(g)+H2O(g) CO2(g)+H2(g) △H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
CO2(g)+H2(g) △H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
①0~10min内H2O(g)的平均反应速率为 。
②若想加快正反应速率的同时提高CO的转化率,可以采用的方法是 。
a.升高温度 b.缩小容器的体积
c.增大H2O (g)的浓度 d.加入适当的催化剂
③若保持温度容积不变再向其中充入1molCO和0.5molH2O(g),重新达到化学平衡状态时,此时平衡混合气体中H2的体积分数为 。
(3)甲醇燃料电池是符合绿色化学理念的新型燃料电池,下图是以甲醇燃料电池(甲池)为电源的电解装置。已知:A、B、C、D、E、F都是惰性电极,丙中为0.1 mol/L CuSO4溶液 (假设反应前后溶液体积不变) ,当向甲池通入气体a和b时,D极附近呈红色。回答下列问题:
①a物质是 ,A电极的电极反应式为 。
②乙装置中的总化学反应方程式为 。
③当乙装置中C电极收集到224mL(标况下)气体时, 丙中溶液的pH= 。
CH4和CO2反应可以制造价值更高的化学产品。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生反应:CO2(g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
| 物 质 |
CH4 |
CO2 |
CO |
H2 |
| 平衡浓度(mol·L-1) |
0.5 |
0.5 |
2.0 |
2.0 |
①此温度下,该反应的平衡常数K=__________________(注明单位)。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=a kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2(g) △H2=b kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H3=c kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g)的△H=________kJ·mol-1。
2CO(g)+2H2(g)的△H=________kJ·mol-1。
(2)用Cu2Al2O4做催化剂,发生反应: CO2+CH4 CH3COOH, 请回答:
CH3COOH, 请回答:
①温度与催化剂的催化效率和乙酸的生成速率如图。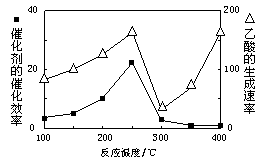
250~300℃时,温度升高而乙酸的生成速率降低的原因是 。
②为提高上述反应CH4的转化率,可采取的措施有 (写2种)。
③Cu2Al2O4可溶解在稀硝酸中,被氧化的元素为 ,每消耗3mol Cu2Al2O4时被还原的HNO3为 mol。
(3)Li2O、Na2O、MgO均能吸收CO2,
①若寻找吸收CO2的其他物质,下列建议合理的是 。
a.可在碱性氧化物中寻找
b.可在具有强氧化性的物质中寻找
c.可在ⅠA、ⅡA族元素的氧化物中寻找
②Li4SiO 4可用于吸收、释放CO2, 原理是: 500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,该原理的化学方程式 。
(14分)
(1)已知:①N2(g)+O2(g)=2NO(g) △H=+179.5 kJ/mol
②2NO(g)+O2(g)=2NO2(g) △H=-112.3 kJ/mol
③2NO(g)+2CO(g)=N2(g) +2CO2(g) △H=-759.8 kJ/mol
NO2(g)+CO(g)=NO(g) +CO2(g) △H= kJ/mol。
(2)将不同物质的量的H2O(g)和CO(g)分别通入体积为2 L的恒容密闭容器中,进行反应:H2O(g)+CO(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min[ |
||
| H2O |
CO |
CO |
H2 |
|||
| ① |
650 |
2 |
4 |
2.4 |
1.6 |
5 |
| ② |
900 |
1 |
2 |
1.6 |
0.4 |
3 |
| ③ |
900 |
a |
b |
c |
d |
t |
①实验组①中以v(CO2)表示的反应速率为 ,此温度下的平衡常数为 ,温度升高时平衡常数会 (填“增大”、“减小”或“不变”)。
②650 ℃时,若在此容器中开始充入2 mol H2O(g)、1 mol CO、1 mol CO2和 2 mol H2,若要使反应在开始时 进行。(填“正向”、“逆向”)
③若a=2,b=1,则c= ,达平衡时实验组②中H2O(g)和实验组③中CO的转化率的关系为
α2 (H2O) α3 (CO)(填“<”、“>”或“=”)。
(14分)CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法。
I、甲醇可以补充和部分替代石油燃料,缓解能源紧张。利用CO可以合成甲醇。
(2)一定条件下,在容积为VL的密闭容器中充入α mol CO与2a mol H2合成甲醇平衡转化率与温度、压强的关系如图所示。
①P1__P2(填“>”、“<”或“=”),理由是
②该甲醇合成反应在A点的平衡常数K= (用a和V表示)
③该反应达到平衡时,反应物转化率的关系是:CO H2(填“>” 、“<” 或“="”" )
④下列措施中能够同时满足增大反应速率和提高CO转化率的是 。(填写相应字母)
| A.使用高效催化剂 |
| B.降低反应温度 |
| C.增大体系压强 |
| D.不断将CH30H从反应混合物中分离出来 |
E、增加等物质的量的CO和H2
Ⅱ、某学习小组以SO2为原料,采用电化学方法制取硫酸。
(3)原电池法:该小组设计的原电池原理如图所示。写出该电池负极的电极反应式 。
(4)电解法:该小组用Na2SO3溶液充分吸收S02得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如下图所示。
写出开始电解时阳极的电极反应式 。
(14分)SO2 、CO 、NOx 是对环境影响较大的气体,对它们的合理控制和治理是优化我们生存环境的有效途径。请回答下列问题:
(1)已知25℃、101kPa时:
2SO2(g) + O2(g)  2SO3(g) △H1 =" -" 197 kJ•mol-1
2SO3(g) △H1 =" -" 197 kJ•mol-1
H2O(g) = H2O(l) △H2 =" -" 44 kJ•mol-1
2SO2(g) + O2(g) + 2H2O(g) = 2H2SO4(l) △H3 =" -" 545 kJ•mol-1
则SO3(g)与H2O(l)反应的热化学方程式是 。
(2)若反应2H2(g)+ O2 (g)=2H2O(g ),△H=-241.8kJ•mol-1,根据下表数据则x=______kJ•mol-1。
| 化学键 |
H-H |
O═O |
O-H |
| 断开1mol化学键所需的能量/kJ |
436 |
x |
463 |
(3)甲醇汽油也是一种新能源清洁燃料。工业上可用CO和H2制取甲醇,热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H=-90 kJ•mol-1
CH3OH(g) △H=-90 kJ•mol-1
①该温度下,在两个容积均为1 L的密闭容器中,分别发生该反应:
| 容器 |
甲 |
乙 |
| 反应物投入量 |
1 mol CO (g)和2 mol H2(g) |
1 mol CH3OH(g) |
| 平衡时c(CH3OH) |
c1 |
c2 |
| 平衡时能量变化 |
放出54kJ |
吸收a kJ |
则c1_________ c2(填“>”或“<”或“=”),a=____________。
②若密闭容器容积与①相同,Ⅰ、Ⅱ曲线分别表示投料比不同时的反应过程。若Ⅱ反应的n(CO)起始 ="10" mol、投料比为0.5,则:
A点的平衡常数KA= ,
B点的平衡常数KB KA。(填“>”或“<”或“=”)
③为提高CO转化率可采取的措施是 (至少答出两条)。
(4)电解NO制备NH4NO3,其工作原理如图所示,
则a电极名称为_______,
b电极反应式为_________________。
(15分)二氧化碳的过度排放会引发气候问题,而进行有效利用则会造福人类,如以CO2和NH3 为原料合成尿素。经研究发现该反应过程为:
①CO2(g)+2NH3(g) NH2COONH4(s) △H1
NH2COONH4(s) △H1
②NH2COONH4(s) CO(NH2)2(s)+H2O(g) △H2>0
CO(NH2)2(s)+H2O(g) △H2>0
请回答下列问题:
(1)研究反应①的平衡常数(K)与温度(T)的关系,如图1所示,则△H1____0。(选填“>”、“<”或“=”)。
(2)有体积可变(活塞与容器之间的摩擦力忽略不计)的密闭容器如图2所示,现将3molNH3和2molCO2放入容器中,移动活塞至体积V为3L,用铆钉固定在A、B点,发生合成尿素的总反应如下:
CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
测定不同条件、不同时间段内的CO2的转化率,得到如下数据:
| CO2的转化率T(℃) |
10min |
20min |
30min |
40min |
| T1 |
30% |
65% |
75% |
75% |
| T2 |
45% |
50% |
a1 |
a2 |
①T1℃下,l0min内NH3的平均反应速率为__________。
②根据上表数据,请比较T1_________T2(选填“>”、“<”或“=”);T2℃下,第30min时,a1=________,该温度下的化学平衡常数为_________。
③T2℃下,第40min时,拔去铆钉(容器密封性良好)后,活塞没有发生移动,再向容器中通人3molCO2,此时v(正)_____v(逆)(选填“>”、“<”或“=”),判断的理由是______。
(3)请在下图中补画出合成氨总反应2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)过程中能量变化图,并标明中间产物〔NH2COONH4(s)〕、 生成物CO(NH2)2(s)+H2O(g)〕。
CO(NH2)2(s)+H2O(g)过程中能量变化图,并标明中间产物〔NH2COONH4(s)〕、 生成物CO(NH2)2(s)+H2O(g)〕。
氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1)氢气作为能源最大的优点是燃烧产物是水,无污染。请你再列举一条氢气作为能源的优点:_____________________________________________。
(2)LiAlH4是一种重要的储氢载体,能与水反应得到LiAlO2和氢气,该反应消耗1mol LiAlH4时转移的电子数目为_______________________________________。
(3)氮化锂(Li3N)是非常有前途的储氢材料,其在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为;Li3N+2H2 LiNH2+2LiH,氧化产物为___________(填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的___________%(精确到0.1)。
LiNH2+2LiH,氧化产物为___________(填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的___________%(精确到0.1)。
(4)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
在某温度下,向恒容密闭容器中加入环己烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=__________。
(5)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
①导线中电子移动方向为__________。(用A、D表示)
②生成目标产物的电极反应式为_______________________________。
③该储氢装置的电流效率η=_________________。
(η= ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
天然气含有硫化氢气体,回收并综合利用硫化氢有重要的经济价值和环境保护意义。如硫化氢可经过一系列反应制得硫酸: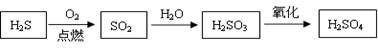
(1)物质发生不完全燃烧时的反应热难以通过实验测得。已知硫化氢气体的燃烧热是586 kJ/mol,固体硫单质的燃烧热是297kJ·mol-1。写出硫化氢气体不完全燃烧生成固体硫单质的热化学方程式 。
(2)工业生产中硫化氢尾气可用NaOH溶液吸收。
①吸收尾气后得到的Na2S溶液显 性(填“酸”、“碱”、“中”);
②下列与H2S、NaHS和Na2S相关的离子方程式正确的是(填字母序号)_________。
| A.H2S+OH—=HS—+H2O | B.HS—+H2O=H2S+OH— |
C.HS—+H2O S2—+H3O+ S2—+H3O+ |
D.S2—+H2O H2S+2OH— H2S+2OH— |
(3)在一定温度下,某容器中发生2H2S(g) 2H2(g)+S2(g)的反应,测得相应时间时部分物质的浓度(mol·L-1)如下表,根据表中数据回答问题:
2H2(g)+S2(g)的反应,测得相应时间时部分物质的浓度(mol·L-1)如下表,根据表中数据回答问题:
 时间 时间物质 |
0 min |
20 min |
60 min |
90 min |
120 min |
| H2S |
|
|
0.006 |
0.005 |
|
| H2 |
0 |
0.002 |
0.004 |
|
|
| S2 |
0 |
|
0.002 |
|
0.0025 |
①判断90 min时反应速率v(正)______v(逆)(填“>”、“=”或“<”);
②求该温度下反应的化学平衡常数(不必写出计算过程)K=______ ___。
(4)以硫化氢为原料,使用质子固体电解质(能传导H+)构成燃料电池,硫化氢放电后生成硫蒸气(化学式S2),该燃料电池的负极反应式为_________ ____。
(5)硫酸是强酸,在图中画出硫酸溶液和氢氧化钠溶液反应过程的能量变化示意图。
目前“低碳经济”正成为科学家研究的主要课题。请回答 下列问题
I.甲烷自热重整是一种先进的制氢方法其反应方程式为:CH4(g) + H2O(g) ="CO(g)" + 3H2(g)
(1)阅读下图计算该反应的反应热ΔH = __________kJ/mol。
II.用CH4或其他有机物、O2为原料可设计成燃料电池。
(2)以CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池则负极的电极反应式为___________。
(3)以CH4、O2为原料,100 mL 0.15 mol/L NaOH溶液为电解质设计成燃料电池,若放电时参与反应的氧气体积为448 mL(标准状况),产生的气体全部被溶液吸收,则所得溶液中溶质的成分及物质的量之比为_____,各离子浓度由大到小的顺序为_______________。
III.利用I2O5消除CO污染的反应为:5CO(g) + I2O5(s) =5CO2(g) + I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数随时间t变化曲线如图。
请回答:
(4)T2时,0 ~ 0.5 min内的反应速率v(CO) = ____________________。
(5)T1时化学平衡常数K = ____________________。
(6)下列说法不正确的是____________________填字母序号)。
| A.容器内气体密度不变表明反应达到平衡状态 |
| B.两种温度下,c点时体系中混合气体的压强相等 |
| C.d点时,增大体系压强,CO的转化率不变 |
| D.b点和d点时化学平衡常数的大小关系:Kb < Kd |
工业上由焦炭或夭然气制氢气的过程中会产生一氧化碳。为了除去氢气中混有的一氧化碳,可在催化剂存在的条件下将一氧化碳与水蒸气发生反应:
CO(g)+H2O(g) CO2(g)+H2(g) △H="-41.0" kJ·mol-l .
CO2(g)+H2(g) △H="-41.0" kJ·mol-l .
该反应在工业上被称为“一氧化碳变换”。
(1)写出该反应的平衡常数表达式:K= ;K ( 200℃) K ( 300℃) (填 “>”、“=”或“<”)。
(2)在773K时,一氧化碳发生反应的平衡常数K=9,如反应开始时CO和H2O的浓度都是0.020·mol-l ,则在此反应条件下一氧化碳的转化率为 。
(3)某工业合成氨的原料气组成为:H2 40%、N2 20%、CO30%、CO210%(均为体积分数)。现采用“一氧化碳变换”法,向上述原料气中加入水蒸气,以除去其中的CO。已知不同温度及反应物投料比( )下,变换后平衡混合气体中CO的体积分数如下表所示:
)下,变换后平衡混合气体中CO的体积分数如下表所示:
| CO的体积分数/% 投料比 温度/℃ |
 =1 =1 |
 =3 =3 |
 =5 =5 |
| 200 |
1.70 |
0.21 |
0.02 |
| 250 |
2.73 |
0.30 |
0.06 |
| 300 |
6.00 |
0.84 |
0.43 |
| 350 |
7.85 |
1.52 |
0.80 |
①从表中数据可以得到控制不同条件时CO的转化率的变化规律。能使CO的转化率升高,可改变的条件是 、 。
②温度是一氧化碳变换工艺中最重要的工艺条件,实际生产过程中将温度控制在300℃左右,其原因是 。
③温度为300℃、 =1时,反应后的平衡混合气体中CO2的体积分数是 。(结果保留3位有效数字)o
=1时,反应后的平衡混合气体中CO2的体积分数是 。(结果保留3位有效数字)o
(16分)I.合成氨的原料气H2可通过反应CO(g)+H2O(g) CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
(1)T℃时,向容积固定为5L的容器中充入1mol水蒸气和1molCO,反应达平衡后,测得CO的浓度为0.08mol·L-1,则平衡时CO的转化率为 ,该温度下反应的平衡常数K值为 。
(2)保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入固定容器中进行反应,下列描述能够说明体系处于平衡状态的是 (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成amolCO2的同时消耗amolH2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
II.(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧实验中相关的反应有:
①4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H1
②4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H2
③4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H3
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= 。
(2)美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂作为电极、加入碱性电解质溶液,其电池反应为4NH3+3O2=2N2+6H2O
①写出该燃料电池的正极反应式 。
②若用该燃料电池产生的电能在铁皮上镀锌(制白铁皮),某铁皮上现需要镀上9.75g锌,理论上至少需要消耗标准状况的氨气 L。
III.(1)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。由图可知Mg与卤素单质的反应均为 (填“放热”或“吸热”)反应。
(2)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体和沉淀生成。写出CH3MgCl水解的化学方程式 。
(15分)2013年以来,我国多地频现种种极端天气。二氧化碳、氮氧化物、二氧化硫是导致极端天气的重要因素。
(1)用钌的配合物作催化剂,一定条件下可直接光催化分解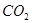 ,发生反应:
,发生反应: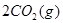 =2CO(g)+
=2CO(g)+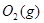 △H>0,该反应的
△H>0,该反应的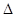 S 0(填“>”“<”或“=”),在低温下,该反应 (填“能”或“不能”)自发进行。
S 0(填“>”“<”或“=”),在低温下,该反应 (填“能”或“不能”)自发进行。
(2)活性炭可用于处理大气污染物NO。在1 L恒容密闭容器中加入0.100 mol NO和2.030 mol固体活性炭(无杂质),生成气体E和气体F。当温度分别在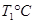 和
和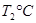 时,测得平衡时各物质的物质的量如下表:
时,测得平衡时各物质的物质的量如下表: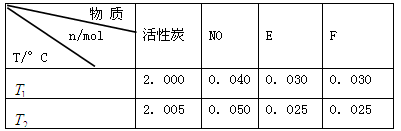
①请结合上表数据,写出NO与活性炭反应的化学方程式: 。
②上述反应在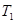 ℃时的平衡常数为
℃时的平衡常数为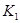 ,在
,在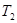 ℃时的平衡常数为
℃时的平衡常数为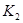 。
。
计算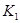 = 。根据上述信息判断,
= 。根据上述信息判断,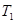 和
和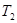 的关系是 。
的关系是 。
a.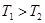 b.
b.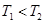 c.无法比较
c.无法比较
③在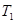 ℃下反应达到平衡后,下列措施不能改变NO的转化率的是____。
℃下反应达到平衡后,下列措施不能改变NO的转化率的是____。
a.增大c(NO) b.增大压强 c.升高温度 d.移去部分F
(3)碘循环工艺不仅能吸收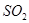 降低环境污染,同时又能制得氢气,具体流程如下:
降低环境污染,同时又能制得氢气,具体流程如下: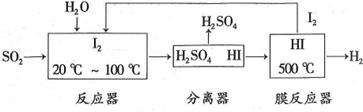
①用离子方程式表示反应器中发生的反应 。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出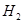 的目的是: 。
的目的是: 。
(4)开发新能源是解决大气污染的有效途径之一。直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示:
通过a气体的电极是原电池的 极(填“正”或“负”),其电极反应式为 。
(15分,除标明外,其余每空2分)物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2 2(t-BuNO)
2(t-BuNO)
(1)当(t-BuNO)2的起始浓度(c0)为0.50mol·L-1时,实验测得20℃时的平衡转化率(α)是60%。20℃时上述反应的平衡常数K= 。
(2)一定温度下,随着(t-BuNO)2的起始浓度增大,其平衡转化率 (填“增大”、“不变”或“减小”)。已知20℃时该反应在CCl4溶剂中的平衡常数为1.70mol·L-1,若将反应溶剂正庚烷改成CCl4,并保持(t-BuNO)2起始浓度相同,则它在CCl4溶剂中的平衡转化率 (填“大于”、“等于”或“小于”)其在正庚烷溶剂中的平衡转化率。
(3)实验测得该反应的ΔH=+50.5kJ·mol-1,活化能Ea=90.4kJ·mol-1。下列能量关系图合理的是 (填字母)。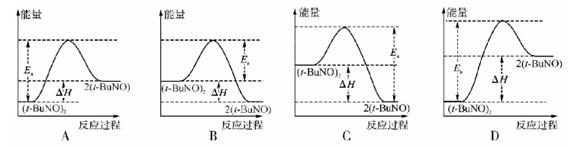
(4)该反应的ΔS (填“>”、“<”或“=”)0。在 (填“较高”或“较低”)温度下有利于该反应自发进行。
(5)通过比色分析得到30℃时(t-BuNO)2浓度随时间的变化关系如图所示,请在同一图中绘出t-BuNO浓度随时间的变化曲线
(14分)运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)某硝酸厂处理尾气中NO的方法是:催化剂存在时用H2将NO还原为N2。已知:
则氮气和水蒸气反应生成氢气和一氧化氮的热化学方程式是 。
(2)在压强为0.1 Mpa条件,将a mol CO和3a mol H2的混合气体在催化剂作用下转化为甲醇的反应如下:CO(g)+2H2(g) CH3OH(g) ΔH<0。
CH3OH(g) ΔH<0。
①该反应的平衡常数表达式为________________。
②若容器容积不变,下列措施可增大甲醇产率的是________。
A.升高温度
B.将CH3OH从体系中分离
C.充入He,使体系总压强增大
(3)某研究小组在实验室研究某催化剂效果时,测得NO转化为N2的转化率随温度变化情况如图。
①若不使用CO,温度超过775 ℃,发现NO的分解率降低,其可能的原因为________;在n(NO)/n(CO)=1的条件下,应控制最佳温度在________左右。
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染。
写出C2H6与NO2发生反应的化学方程式________________。
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如右图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,则该电极反应式为________________________。
试题篮
()