(12分)在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g)  2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
(1)该温度下,若温度升高,K值将________(填“增大”、“减小”或“不变”)。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的是________点。从起点开始首次达到平衡时,以NO2表示的反应速率为____________。
(3)25 min时,加入了__________(填加入物质的化学式及加入的物质的量),使平衡发生了移动。
(4)d点对应NO2的物质的量浓度________(填“大于”、“小于”或“等于”)0.8 mol·L-1,理由是_______________________________________________________________________。
Ⅰ、火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 KJ。
此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
Ⅱ、下图表示在密闭容器中反应:2SO2+O2 2SO3, △H< 0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 ;若增大压强时,反应速度变化情况画在c~d处.。
2SO3, △H< 0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 ;若增大压强时,反应速度变化情况画在c~d处.。
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)利用反应:6NO2 + 8NH3 7N2 + 12 H2O处理NO2。120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均反应速率υ(NO2) =______。
7N2 + 12 H2O处理NO2。120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均反应速率υ(NO2) =______。
(2)一定条件下SO2与NO2可发生反应,方程式:NO2(g)+SO2(g)  SO3(g)+NO(g) △H>0 将NO2与SO2以体积比1:2置于密闭容器中反应,下列能说明反应达到平衡状态的是 __ 。
SO3(g)+NO(g) △H>0 将NO2与SO2以体积比1:2置于密闭容器中反应,下列能说明反应达到平衡状态的是 __ 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.NO2和SO3的体积比保持不变
d.混合气体的平均相对分子质量保持不变
(3)如果上述反应的平衡常数K值变大,该反应___________(填序号)。
a.一定向正反应方向移动
b.平衡移动时,正反应速率先减小后增大
c.一定向逆反应方向移动
d.平衡移动时,逆反应速率先增大后减小
830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g) CO2(g)+H2(g) △H>0
CO2(g)+H2(g) △H>0
试回答下列问题:
(1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为50%,则在该温度下,该反应的平衡常数K= .
(2)在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),你判断的依据是
(3)若降低温度,该反应的K值将 ,该反应的化学反应速率将 (均填“增大”“减小”或“不变”)。
Ⅰ 恒温、恒压下,在一个可变容积的容器中发生如下反应: A(气)+B(气) C(气)。
C(气)。
(1)若开始时放入1 mol A和1 mol B,到达平衡后,生成a mol C,这时A的物质的量为 mol,
(2)若开始时放入3 mol A和3 mol B,到达平衡后,生成C的物质的量为 mol。
(3)若开始时放入x mol A、2 mol B和1 mol C,到达平衡后,A和C的物质的量分别是y mol和3a mol,则x= mol,y= mol。平衡时,B的物质的量 (选填一个编号)。
(甲)大于2 mol (乙)等于2 mol
(丙)小于2 mol (丁)可能大于、等于或小于2 mol
Ⅱ 若维持温度不变,在一个与(Ⅰ)反应前起始体积相同、且容积固定的容器中发生上述反应。
(4)开始加入1 mol A和1mol B 时A的转化率为m,若开始时加入1 mol A和2 mol B 时A的转化率为n,则m n(“>”、“<”、“=”)
(5)开始时放入1 mol A和1 mol B到达平衡后生成b mol C。将b与(1)小题中的a进行比较____(选填一个编号)。
(甲)a<b (乙)a>b (丙)a="b" (丁)不能比较a和b的大小
氯气在298K、100kPa时,在1L水中溶解0.09mol即达饱和,实验测得溶于水的Cl2有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为_____ _____; 计算上述体系的平衡常数_____ 。
(2)若在该饱和氯水中①加入少量NaOH固体,平衡将向________移动,溶液的pH值将 (“增大”、 “减小”、“不变”);②通入适量氯气平衡将________移动。(填“向左”、“向右”、“不移动”)
(3)如果增大氯气的压强,平衡将向_________移动(填“左”、“右”)。氯气在水中的溶解度将______。(填“增大”、“减小”或“不变”),参与反应的氯气与溶解氯气的比值将______1/3(填“大于”、“小于”或“等于”)。
(8分)能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质。一定条件下,在体积为2 L的密闭容器中,1mol一氧化碳与2mol氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g) CH3OH(g) △H<0
CH3OH(g) △H<0
根据题意完成下列各题:
反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,10min反应达平衡,此时甲醇的物质的量浓度为0.3mol/L,从反应开始到平衡,氢气的平均反应速率v(H2)= 。
(3)在其它条件不变的情况下,把反应处于平衡体系的容器的体积压缩为1 L,下列有关该体系的说法正确的是 。
| A.平衡向正反应方向移动 | B.正反应速率加快,逆反应速率减慢 |
| C.甲醇的物质的量增加 | D.重新平衡时c(CO)/c(CH3OH)不变 |
向恒容密闭容器中充入2.0 mol A和3.0 mol B,发生反应xA(g)+2B(g)  yC(g)。恒温下反应10 min后突然改变某一条件,12 min时达到化学平衡状态I;18 min时升高温度,22 min时达到化学平衡状态II。容器中A、C的物质的量浓度随时间变化的曲线如图所示,请根据题给信息回答下列问题:
yC(g)。恒温下反应10 min后突然改变某一条件,12 min时达到化学平衡状态I;18 min时升高温度,22 min时达到化学平衡状态II。容器中A、C的物质的量浓度随时间变化的曲线如图所示,请根据题给信息回答下列问题:
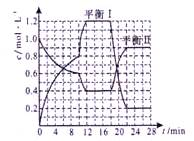
(1)从反应开始到10 min时,该反应的平均速率v(A)= ;平衡状态I时,反应物A的转化率a(A)=__________。x:y=__________。
(2)容器内的压强:平衡状态I与起始状态相比较是__________(选填“增大”、“减小”、 “相等”或“无法判断”),逆反应为___________反应(选填“放热”或“吸热”)。
(3)推测第10 min时改变的反应条件可能是___________(选填编号)。
①减压 ②降温 ③升温 ④加催化剂 ⑤增加B的量 ⑥充入氦气
(4)若已知平衡状态I时B的物质的量为0.6 mol,平衡状态I和平衡状态Ⅱ时该反应的平衡常数分别为K1和K2。则Kl=_ ,且K1__________K2(选填“>”、“<”或“=”)。
CO和NO都是常见的不成盐氧化物。回答下列问题:
(1)工业土用一氧化碳制取氢气的反应为:CO(g) + H2O(g) CO2(g) + H2(g),
已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 。
恒温恒容条件下,以下能说明该反应达到平衡状态的是 (填字母序号)。
a.V消耗(CO) = V生成(H2O)
b. c(CO2)=c(CO)
c. 混合气体的总物质的量不再改变
d. 混合气体的密度不再改变
(2)①汽车发动机工作时会引发N2和02反应,其能量变化示意图如下:

写出该反应的热化学方程式: _ 。
②通过NOx传感器可监测NOx的含量,其工作原理如图,写出NiO电极的电极反应式: 。
根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:
2N2(g)+6H2O(l) 4NH3(g)+3O2(g) ΔH=" +" 1 530 kJ/mol
4NH3(g)+3O2(g) ΔH=" +" 1 530 kJ/mol
又知:H2O(l) H2O(g) ΔH=" +" 44.0 kJ/mol
H2O(g) ΔH=" +" 44.0 kJ/mol
则2N2(g)+6H2O(g) 4NH3(g)+3O2(g) ΔH= kJ/mol,该反应的化学平衡常数表达式为K= ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
4NH3(g)+3O2(g) ΔH= kJ/mol,该反应的化学平衡常数表达式为K= ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
反应m A+n B p C+q D在某温度下达到平衡。
p C+q D在某温度下达到平衡。
①若A、B、C、D都是气体,保持温度不变,将气体体积压缩到原来的一半,当再次达到平衡时C的物质的量浓度变为原来的1.8倍,则m、n、p ,q的关系是_____________。
②若A、B、C、D都为气体,且m+ n =" p+" q,则将气体体积压缩后A的物质的量将_________(填“减小”“增大”“不变”),平衡必定______移动。(填“正向”或“逆向”或“不”)
③若给体系升温, B的物质的量减少,则正反应为 ________反应(填“放热”“吸热”)
④若在体系中增加A的量,平衡不发生移动,则A肯定不能为_____态
⑤若加正催化剂,则反应物的转化率将________(填“减小”“增大”“不变”)
在400℃时,将一定量SO2和14molO2投入一个盛有催化剂的10L密闭容器中进行反应2SO2+O2 2SO3,已知2min后容器中剩余2molSO2和12molO2,则:
2SO3,已知2min后容器中剩余2molSO2和12molO2,则:
(1)生成了_______ mol SO3, SO2起始物质的量的浓度是________ mol/L―1。
(2)V(SO2)是_______ mol/L―1.min―1, V(SO3)是_________ mol/L―1.S―1。
可逆反应3A(g)3B(?)+C(?) ΔH>0达到化学平衡后,
(1)升高温度,用“变大”、“变小”、“不变”或“无法确定”填空。
①若B、C都是气体,气体的平均相对分子质量 。
②若B、C都不是气体,气体的平均相对分子质量 。
③若B是气体,C不是气体,气体的平均相对分子质量 。
如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,
则B是 态,C是 态。
在一定条件下,可逆反应:mA+nBpC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是 。
(2)A、C是气体,增加B的量,平衡不移动,则B为 态。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是 。
(4)加热后,可使C的质量增加,则正反应是 反应(填“放热”或“吸热”)。
试题篮
()