Ⅰ.已知可逆反应:M(g)+N(g)  P(g)+Q(g) ΔH>0,请回答下列问题:
P(g)+Q(g) ΔH>0,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为c(M)=1 mol·L-1,c(N)=2.4 mol·L-1。达到平衡后,M的转化率为60%,此时N的转化率为____________。
(2)若反应温度升高,M的转化率__________(填“增大”、“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4 mol·L-1,c(N)=a mol·L-1;
达到平衡后,c(P)=2 mol·L-1,a=____________。
Ⅱ.在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应
A(g) B(g)+C(g) △H=+85.1kJ·mol-1
B(g)+C(g) △H=+85.1kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h |
0 |
1 |
2 |
4 |
8 |
16 |
20 |
25 |
30 |
| 总压强p/100kPa |
4.91 |
5.58 |
6.32 |
7.31 |
8.54 |
9.50 |
9.52 |
9.53 |
9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为 。
(2)由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为 。
平衡时A的转化率为_ ,列式并计算反应的平衡常数K 。
可逆反应:aA(g)+ bB(g) cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答:
(1)压强 P1比P2 (填大或小); (2)(a +b)比(c +d) (填大或小);
(3)温度t1℃比t2℃ (填高或低);(4)正反应为 反应。
对于平衡体系mA(g)+nB(g)  pC(g)+qD(g) 按题目的要求写出可能采取的措施。
pC(g)+qD(g) 按题目的要求写出可能采取的措施。
(1)正、逆反应速率都改变,但平衡不移动,则改变的条件可能是:① ,②若 ,则改变的条件是压强。
(2)只改变正反应速率或只改变逆反应速率,则改变的条件可能是单独改变 或是单独改变 。
(3)正、逆反应速率发生不同程度的变化,则改变的条件可能是:① ,②若 ,则改变的条件是压强。
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)利用反应:6NO2 + 8NH3 7N2 + 12 H2O处理NO2。120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均反应速率υ(NO2) =______。
7N2 + 12 H2O处理NO2。120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均反应速率υ(NO2) =______。
(2)一定条件下SO2与NO2可发生反应,方程式:NO2(g)+SO2(g)  SO3(g)+NO(g) △H>0 将NO2与SO2以体积比1:2置于密闭容器中反应,下列能说明反应达到平衡状态的是 __ 。
SO3(g)+NO(g) △H>0 将NO2与SO2以体积比1:2置于密闭容器中反应,下列能说明反应达到平衡状态的是 __ 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.NO2和SO3的体积比保持不变
d.混合气体的平均相对分子质量保持不变
(3)如果上述反应的平衡常数K值变大,该反应___________(填序号)。
a.一定向正反应方向移动
b.平衡移动时,正反应速率先减小后增大
c.一定向逆反应方向移动
d.平衡移动时,逆反应速率先增大后减小
如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视,所以“低碳经济”正成为科学家研究的主要课题。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中。
进行反应 得到如下两组数据:
得到如下两组数据:
①实验1从开始到达到化学平衡时,以v(CO2)表示的反应速率为 。(精确到0.01,下同)
②该反应为 (填“吸”或“放”)热反应,实验2条件下平衡常数K= 。
(2)以二甲醚(CH3OCH3)、空气、氢氧化钾为原料,铂为电极可构成燃料电池,其工作原理与甲烷燃料电池的原理相似。请写出该电池负极上的电极反应式: 。
(3)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为- 285.8 kJ·mol-1、- 283.0 kJ·mol -1和- 726.5 kJ·mol-1。请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
在某一容积为5 L的密闭容器内,加入 0.2 mol的CO和0.2 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g),ΔH<0,反应中CO2的浓度随时间变化情况如右图:
CO2(g)+H2(g),ΔH<0,反应中CO2的浓度随时间变化情况如右图:
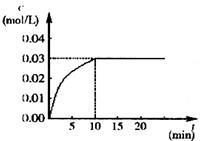
(1)根据图中数据计算反应开始至达到平衡时CO的化学反应速率为v(CO)= ;若升高温度,则化学平衡常数K (填“增大”“减小”或“不变”)。
(2)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.1 mol的CO2和0.1 mol的H2,在相同的条件下,反应CO(g)+H2O(g)  CO2(g)+H2(g)向 (填“正反应”或“逆反应”)方向进行,其依据是 。反应达平衡时,c(H2O)= 。
CO2(g)+H2(g)向 (填“正反应”或“逆反应”)方向进行,其依据是 。反应达平衡时,c(H2O)= 。
已知可逆反应:M(g)+N(g) P(g)+Q(g)ΔH>0,请回答下列问题:
P(g)+Q(g)ΔH>0,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)="1" mol·L-1,c(N)="2.4" mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为 ;
(2)若反应温度升高,M的转化率 (填“增大”“减小”或“不变”);
(3)若反应温度不变,反应物的起始浓度分别为:c(M)="4" mol·L-1,c(N)="a" mol·L-1;达到平衡后,c(P)="2" mol·L-1,a= ;
(4)若反应温度不变,反应物的起始浓度为:c(M)="c(N)=b" mol·L-1,达到平衡后,M的转化率为 。
已知可逆反应:M(g)+N(g) P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1, c(N)="2.4" mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为 。
(2)若反应温度升高,M的转化率 (填“增大”“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为:c(M)=" 4" mol·L-1,c(N)=amol·L-1;达到平衡后,c(P)="2" mol·L-1,a= 。
(4)若反应温度不变,反应物的起始浓度为:c(M)="c(N)=" bmol·L-1,达到平衡后,M的转化率为 。
汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g) + O2(g)  2NO(g) △H > 0
2NO(g) △H > 0
已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)该反应的平衡常数表达式为 。
(2)该温度下,向2L密闭容器中充入N2和O2各1mol,平衡时,N2的转化率是 %(保留整数)。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应 (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是 。
(4)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是 (填字母序号)。
(5)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数 (填“变大、“变小”或“不变”)。
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
| T/℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应为 反应(填“吸热”、“放热”)。
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离出CO气体 b.适当升高温度
c.增大CO2的浓度 d.选择高效催化剂
(3)能判断该反应已达到化学平衡状态的依据是 。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为 ℃。
(5)若在(4)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为 mol,CO的体积分数为 。
根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:
2N2(g)+6H2O(l) 4NH3(g)+3O2(g) ΔH=" +" 1 530 kJ/mol
4NH3(g)+3O2(g) ΔH=" +" 1 530 kJ/mol
又知:H2O(l) H2O(g) ΔH=" +" 44.0 kJ/mol
H2O(g) ΔH=" +" 44.0 kJ/mol
则2N2(g)+6H2O(g) 4NH3(g)+3O2(g) ΔH= kJ/mol,该反应的化学平衡常数表达式为K= ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
4NH3(g)+3O2(g) ΔH= kJ/mol,该反应的化学平衡常数表达式为K= ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
已知2SO2(g)十O2(g) 2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
(1)1mol SO2(g)氧化为1mol SO3(g)放出的热量为99.00kJ·mol-1,写出该反应的热化学方程式 。
(2)①在图中标出该反应的活化能E和反应热△H;

②该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低,请在图中画图表示出来,并进行必要的标注。
(3)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是 。
| A.容器中气体总压强不变 |
| B.容器中混合气体的密度不变 |
| C.每生成1mol SO3的同时生成1molSO2 |
| D.SO2、O2、SO3的物质的量之比为2∶1∶2 |
(4)在400℃,常压下,向体积为2L的密闭容器中充入2mol SO2(g)和1.92mol O2(g),充分反应后,达平衡时测得还有0.04molL-1 SO2剩余,求该反应在平衡时O2 的转化率及SO3的物质的量浓度(要求写出三段式计算过程)。
反应m A+n B p C+q D在某温度下达到平衡。
p C+q D在某温度下达到平衡。
①若A、B、C、D都是气体,保持温度不变,将气体体积压缩到原来的一半,当再次达到平衡时C的物质的量浓度变为原来的1.8倍,则m、n、p ,q的关系是_____________。
②若A、B、C、D都为气体,且m+ n =" p+" q,则将气体体积压缩后A的物质的量将_________(填“减小”“增大”“不变”),平衡必定______移动。(填“正向”或“逆向”或“不”)
③若给体系升温, B的物质的量减少,则正反应为 ________反应(填“放热”“吸热”)
④若在体系中增加A的量,平衡不发生移动,则A肯定不能为_____态
⑤若加正催化剂,则反应物的转化率将________(填“减小”“增大”“不变”)
(1)工业制氢气的一个重要反应是:CO(g)+ H2O(g) ="=" CO2(g) + H2(g)
已知25℃时:C(石墨) +O2 (g) ="=" CO2(g) △H1 =-394 kJ·mol-1
C(石墨) +1/2O2 (g) ="=" CO (g) △H2 =-111 kJ·mol-1
H2(g) +1/2O2 (g)="=" H2O(g) △H3=-242kJ·mol-1
试计算25℃时CO(g)+ H2O(g) ="=" CO2(g) + H2(g)的反应热______kJ·mol-1
(2)830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g) CO2(g)+H2(g);△H<0 试回答下列问题:
CO2(g)+H2(g);△H<0 试回答下列问题:
①若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K= .
②在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”),你判断的依据是
③若降低温度,该反应的K值将 ,该反应的化学反应速率将 (均填“增大”“减小”或“不变”)。
工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g) ⇌CH3OH(g)
(1)下图表示该反应进行过程中能量的变化,曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应是 (填“吸热”或“放热”)反应,写出反应的热化学方程式 ;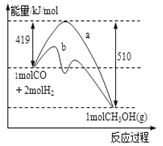
选择适宜的催化剂, (填“能”或“不能”)改变该反应的反应热。
(2)该反应平衡常数K的表达式为K= ,温度升高,平衡常数K (填“增大”、“不变”或“减小”);
(3)恒容条件下,下列措施中能使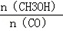 增大的有 。
增大的有 。
a.升高温度 b.充入He气 c.再充入1molCO和2molH2 d.使用催化剂.
试题篮
()