(16分)一种由甲醇、氧气以及强碱做电解质溶液的新型手机电池,容量达氢镍电池或锂电池的10倍,可连续使用一个月才充一次电。请完成下列与甲醇有关的问题。
(1)工业上有一种生产甲醇的反应为:
在温度和容积相同的A、B两个容器中,按不同方式投人反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
①从反应开始到达到平衡时,A中用CO2来表示的平均反应速率为__________________(用含C1的表达式表示)。
②a =_________。
(2)某同学设计了一个甲醇燃料电池,并用该电池电解200mL—定浓度NaCl与CuSO4混合溶液,其装置如图:
①写出甲中通入甲醇这一极的电极反应式__________________________________________
②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t2后,铁电极上的电极反应式_________________________;在t2时所得溶液的pH为______。(假设溶液体积不变)
(3)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如图l所示装置中,以稀土金属材料做惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y203的Zr02固体,它在高温下能传导O2-离子
①d电极的名称为 .
②如图2所示用铂电极电解足量CuS04溶液,b电极上的电极反应式为 .若电解一段时间后要使电解质溶液恢复到电解前的状态,可加入 (填序号).
a.CuO b.Cu(OH)2 c.CuC03 d.Cu2(OH)2C03
在一容积为2 L的密闭容器中,加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生反应:N2(g)+3H2(g)  2NH3(g) ΔH<0反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g) ΔH<0反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
(1)根据上图,计算从反应开始到平衡时,平衡反应速率v(NH3)为__________.
(2)该反应达到平衡时H2的转化率为________.
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为________.(填序号)
a.0.20 mol·L-1 b.0.12 mol·L-1
c.0.10 mol·L-1 d.0.08 mol·L-1
(4)请写出该反应的平衡常数表达式___ ______,若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1 K2(填“>”“="”" 或 “<” )。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol·L-1),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
现有反应aA(g)+bB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应是_______热反应,且a+b______p(填“>”“<”或“=”)。
(2)减压时,A的质量分数________(填“增大”“减小”或“不变”,下同),正反应速率________。
(3)若加入B(体积不变),则A的转化率________,B的转化率________。
(4)若升高温度,则平衡时,B、C的浓度之比 将________。
将________。
(5)若加入催化剂,平衡时气体混合物的总物质的量________。
(6)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色________,而维持容器体积不变,充入氖气时,混合物的颜色________(填“变浅”“变深”或“不变”)。
在10L容器中,加入2mol的SO2(g)和2mol的NO2(g),保持温度恒定,发生反应:SO2(g)+NO2(g) SO3(g)+NO(g)。当达到平衡状态时,测得容器中SO2(g)的转化率为50%。
SO3(g)+NO(g)。当达到平衡状态时,测得容器中SO2(g)的转化率为50%。
(1)该温度下的该反应的平衡常数=__________________(用数值表示)
(2)该温度下、该容器中,再继续加入1mol的SO2(g),则:
①化学平衡将向________方向移动,NO2的转化率将____________;
②经计算,当达到新的平衡状态时,容器中SO2(g)的浓度是_______mol/L;
在100℃时,将0.200 mol的四氧化二氮气体充入2L真空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格:
| 时间 |
0 |
20 |
40 |
60 |
80 |
100 |
| c(N2O4) |
0.100 |
c1 |
0.050[来 |
c3 |
a |
b |
| c(NO2) |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
0.120 |
(1)该反应的化学方程式为_______________________,达到平衡时四氧化二氮的转化率为________%。
(2)20s时四氧化二氮的浓度c1=________mol·L-1,在0~20s时间段内,四氧化二氮的平均反应速率为________mol×L-1×s-1。
(3)若在相同情况下最初向容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的初始浓度为________mol•L-1。
硝基苯甲酸乙酯在OH-存在下发生水解反应:
O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH
O2NC6H4COO-+C2H5OH
两种反应物的初始浓度均为0.050 mol·L-1,15 ℃时测得O2NC6H4COOC2H5的浓度c随时间变化的数据如表所示。回答下列问题:
| t/s |
0 |
120 |
180 |
240 |
330 |
530 |
600 |
700 |
800 |
| c/mol·L-1 |
0 |
0.036 |
0.030 |
0.026 |
0.022 |
0.017 |
0.016 |
0.015 |
0.015 |
(1)计算该反应在120~180 s间的平均反应速率_________;比较120~180 s与180~240 s 区间的平均反应速率的大小,前者_________后者(填>,<或=),理由是____________________。
(2)计算15 ℃时该反应的平衡常数_____________。
(3)为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可采取的措施有________。
A.加入O2NC6H4COOC2H5 B.增加OH-的浓度
C.移去产物 D.加入适当的催化剂
(14分)T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.
(1)写出该反应的方程式:__ ___
(2)计算该温度下该反应的平衡常数:___ ___
(3)若升温A的量增加,则该反应是______热反应.
(4)0~4分钟时,C的平均反应速率为:___ ___
(5)到达平衡时A的转化率为:______
(6)恒容条件下,下列措施中能使n(A)/n(C)减小的有______.
A.充入氦气
B.使用催化剂
C.再充入2.4molA和1.6molB
D.降低温度
(7) 后的某一时刻后,加压,平衡左移,造成这一结果的原因可能是
后的某一时刻后,加压,平衡左移,造成这一结果的原因可能是
高炉炼铁过程中发生的主要反应为:
 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
 Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下表:请回答下列问题:
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
4.0 |
3.7 |
3.5 |
(1)该反应的平衡常数表达式K=________,ΔH________0 ( 填“>”.“<”或“=” );
(2)在体积为10 L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。该时间范围内反应的平均反应速率v(CO2)= ,CO的平衡转化率为 。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是________。
A 减少Fe的量 B 增加Fe2O3的量 C 移出部分CO2
D 提高反应温度 E 减小容器的容积 F 加入合适的催化剂
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为 mol·L-1·s-1反应的平衡常数K1为 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。
①T 100℃(填“大于”“小于”),判断理由是 。
②列式计算温度T时反应的平衡常数K2 。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 ________(填“正反应”或“逆反应”)方向移动,判断理由是 。
在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g) C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。
试回答下列问题:
(1)800℃时,0—5min内,以B表示的平均反应速率为________。
(2)能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K=________,该反应为_______反应(填吸热或放热)。
(4)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol, n(D)=0.9mol,则此时该反应________进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
(19分)(1)已知拆开1 mol H—H键、1 mol I—I、1 mol H—I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ,则由氢气和碘反应生成1 mol HI需要 (填“放出”或“吸收”) kJ的热量。
(2)已知在常温常压下:
①CH3OH(l)+O2(g)=CO(g)+2H2O(l);△H1=-442.8 kJ/mol
②2CO(g)+O2(g)=2CO2(g);ΔH2=-566.0 kJ/mol
写出表示甲醇燃烧热的热化学方程式__________________________________________
(3)已知合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g);ΔH=" -92.2" kJ·mol-1
2NH3(g);ΔH=" -92.2" kJ·mol-1
下表是合成氨反应在某温度下2.0L的密闭容器中进行时,测得的数据:
 时间(h) 时间(h)物质的量(mol) |
0 |
1 |
2 |
3 |
4 |
| N2 |
1.50 |
n1 |
1.20 |
n3 |
1.00 |
| H2 |
4.50 |
4.20 |
3.60 |
n4 |
3.00 |
| NH3 |
0.00 |
0.20 |
n2 |
1.00 |
1.00 |
根据表中数据计算:
①反应进行到2小时时放出的热量为 kJ。
②0~1小时内N2的平均反应速率 mol·L-1·h-1
③此条件下该反应的化学平衡常数K= (保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1mol,化学平衡向 方向移动(填“正反应”或“逆反应”或“不移动”)
可逆反应:aA(g)+ bB(g) cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答:

(1)压强 P1比P2 (填大或小);(2)(a +b)比(c +d) (填大或小);
(3)温度t1℃比t2℃ (填高或低);(4)正反应为 反应。
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
A.容器中压强不变 B.混合气体中 c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
(5)某温度下,将CO和水蒸气各1mol置于体积为1L的密闭容器中反应,达到平衡后测得CO2为0.5mol,再通入4mol水蒸气,达到新的平衡后CO2的物质的量等于__________mol。
(10分)在一定温度下,将2mol A和2mol B两种气体混合于2L密闭容器中,发生反应3A(g)+B(g) 2C(g)+2D(g),2min末反应达到平衡状态,生成0.8 molD。由此推断:
2C(g)+2D(g),2min末反应达到平衡状态,生成0.8 molD。由此推断:
(1)生成D的反应速率 。
(2)B的平衡浓度为 。
(3)A的转化率为 。
(4)该温度下的平衡常数K= 。
(5)如果增大反应体系的压强,则平衡体系中C的转化率 。(填“增大”或“减小”或“不变”)
在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
2.0 |
1.0 |
0.8 |
0.7 |
0.7 |
0.7 |

(1)已知升高温度,NO2的浓度减小,则该反应是 热反应。
(2)下图中表示NO2的变化的曲线是 用O2表示从0~2 s内该反应的平均速率v = 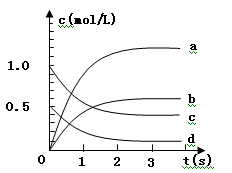
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
试题篮
()