小明体检的血液化验单中,葡萄糖为5.9×10﹣3mol/L.表示该体检指标的物理量是( )
| A.溶解度(s) | B.物质的量浓度(c) | C.质量分数(w) | D.摩尔质量 |
与50 mL 0.2 mol / L NH4Cl溶液中的NH4+浓度相同的是
| A.50 mL 0.2 mol / L CH3COONH4溶液 |
| B.50 mL 0.25 mol / L (NH4)2SO4溶液 |
| C.100 mL 0.2 mol / L NH4NO3溶液 |
| D.50 mL 0.2 mol / L NH3·H2O |
气体体积的大小与许多因素有关.当温度和压强相同时,气体体积主要取决于
| A.气体的物质的量 | B.气体分子之间的平均距离 |
| C.气体分子本身的大小 | D.气体的种类 |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.25 ℃,pH=12的Na2CO3溶液中含有OH-的数目为0.01NA |
B.1 mol苯乙烯(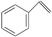 )中含有的碳碳双键数为4NA )中含有的碳碳双键数为4NA |
| C.加热条件下,4.6 g金属Na与足量O2反应的产物中阳离子和阴离子总数为0.3NA |
| D.常温时,1 L 0.1 mol·L-1的硝酸铵溶液中,NH4+和H+总数为0.1NA |
下列关于1.5 mol 氢气的叙述中,正确的是( )
| A.质量是 4 g | B.体积是 33.6 L |
| C.电子数是3 | D.分子数约为 1.5×6.02 ×1023个 |
在标准状况下,下列物质中体积最大的是( )
| A.22.4 L H2 | B.含3.01×1023个分子的Cl2 |
| C.10g NH3 | D.0.8 mol SO2 |
设NA表示阿伏加德罗常数的值,下列叙述中不正确的是
| A.1 mol Cl2与足量NaOH反应,转移的电子数为NA |
| B.常温常压下,11.2 L甲烷中含有的氢原子数小于2 NA |
| C.1 mol碳烯(∶CH2)所含的电子数目为6 NA |
| D.T ℃时,1 L pH=6的纯水中含OH-数为10-6 NA |
下列说法正确的是
① 标准状况下,6.02×1023个分子所占的体积约是22.4L
②0.5molH2所占体积为11.2L
③标准状况下,1molH2O的体积为22.4L
④标准状况下,28gCO与N2的混合气体的体积约为22.4L
⑤各种气体的气体摩尔体积都约为22.4L/mol
⑥标准状况下,体积相同的气体的分子数相同
| A.①③⑤ | B.④⑥ | C.③④⑥ | D.①④⑥ |
在标准状况下,进行甲、乙、丙三组实验。三组实验各取30 ml.同浓度的盐酸,加入同
一种镁、铝混合物粉末,产生气体,有关数据列表如下:

(1)甲、乙两组实验中,哪一组盐酸是不足量的? (填“甲”或“乙”)。理由是
(2)计算盐酸的物质的量浓度;(写出计算过程)
(3)求混合粉末中Mg、Al的物质的量之比?(写出计算过程)
下列各组实验中溶液最先变浑浊的是( )
| A.0.1mol/LNa2S2O3和 H2SO4 各 5mL,加水 5mL,反应温度10℃ |
| B.0.1mol/LNa2S2O3 和 H2SO4各 5mL,加水 10mL,反应温度 10℃ |
| C.0.1mol/L Na2S2O3和H2SO4各 5mL,加水 5mL,反应温度 30℃ |
| D.0.2mol/L Na2S2O3和H2SO4各 5mL,加水 10mL,反应温度 30℃ |
把3.9 g Na2O2放入100mL水中,充分反应后,计算:
(1)生成O2的体积(标准状况);
(2)反应后所得NaOH的物质的量浓度(反应前后溶液体积变化忽略不计)。
NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A.在标准状况下,分子总数为NA的H2和O2混合气体,其体积约为22.4L |
| B.5.6g铁与足量的氯气反应,转移电子数为0.2NA |
| C.11.2LH2O所含有的原子数为1.5NA |
| D.0.2mol/L的Na2CO3溶液中含有的Na+数为0.4NA |
由乙醛和丁酸、乙酸乙酯三种有机物按一定比例组成的混合物中,若含氧的质量分数为A%,则此混合物中含碳的质量分数为( )
| A.6A%/7 | B.(1-A%)/7 | C.6(1-A%)/7 | D.(100-7A/6)% |
下列叙述正确的是( )
| A.常温常压下,1.5 mol N2的体积约为33.6 L |
| B.NaOH的摩尔质量是40 g |
| C.150mL 1 mol/LNaCl溶液与100mL 1 mol/LAlCl3溶液中的n(Cl-)相等 |
| D.同温同压下,相同体积的C12和SO2气体所含的分子数一定相同 |
某次实验需用0.4 mol·L-1 NaOH溶液480 mL。配制方法如下:
(1)配制该溶液应选用_______________mL容量瓶;
(2)用托盘天平准确称量__________g 固体NaOH;
(3)将称量好的NaOH固体放在500 mL大烧杯中,倒入约300 mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待__________________后,将烧杯中的溶液注入容量瓶中;
(4)用少量蒸馏水洗涤烧杯 次,洗涤后的溶液___________________,轻轻晃动容量瓶,使溶液混合均匀;
(5)向容量瓶中加入蒸馏水,到液面_____________时,改用___________加蒸馏水至 盖好瓶塞,上下颠倒.混合均匀.
(6)若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏高的是___________,偏低的是___________,对实验结果没有影响的是___________(填各选项的序号)。
| A.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥 |
| B.配制溶液所用的容量瓶洗净后没有烘干 |
| C.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作 |
| D.转移溶液后,未洗涤烧杯和玻璃棒就直接定容 |
E .最后确定NaOH溶液体积(定容)时,俯视观察液面与容量瓶刻度线
F. 定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线。
试题篮
()