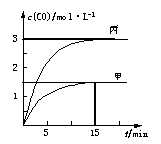
下列是有关外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是
| A.①是其他条件一定时,反应速率随温度变化的图像,则正反应ΔH>0 |
| B.②是在平衡体系的溶液中溶入少量KCl晶体后,化学反应速率随时间变化的图像 |
| C.③是在有无催化剂存在条件下,建立平衡过程的图像,a是使用催化剂时的曲线 |
| D.④是一定条件下,向含有一定量A的恒容密闭容器中逐渐加入B,达平衡时A的转化率的图像 |
可逆反应mA(g)+nB(g) pC(g)+qD(g)的v-t图像如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图像如图乙所示。
pC(g)+qD(g)的v-t图像如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图像如图乙所示。
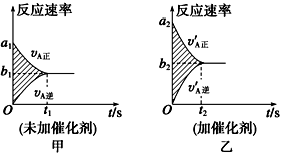
①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2⑥t1=t2
⑦两图中阴影部分面积相等 ⑧图乙中阴影部分面积更大
以上所述正确的为( )
| A.②④⑤⑦ | B.②④⑥⑧ | C.②③⑤⑦ | D.②③⑥⑧ |
700℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2)。
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2)。
| 反应时间/min |
n(CO)/mol |
H2O/mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
|
0.20 |
下列说法正确的是
A.反应在t1 min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D.温度升至800℃,上述反应平衡常数为0. 64,则正反应为吸热反应
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g) 4NO2(g)+ O2(g) △H >0
4NO2(g)+ O2(g) △H >0
T1温度下的部分实验数据为
| t/s |
0 |
500 |
1000 |
1500 |
| C(N2O5)mol/L |
5.00 |
3.52 |
2.50 |
2.50 |
下列说法不正确的是
A.500s内N2O5分解速率为2.96×10-3 mol/(L·s)
B.T1温度下的平衡常数为K1=125,1000s时转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若K1<K2,则T1 >T2
D.平衡后其他条件不变,将容器的体积压缩到原来的1/2,则再平衡时C(N2O5) >5.00mol/L
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应2A(g)+B(g)  2C(g),若2 s(秒)后测得C的浓度为0.6 mol/L,现有下列几种说法:
2C(g),若2 s(秒)后测得C的浓度为0.6 mol/L,现有下列几种说法:
①用物质A表示反应的平均速率为0.3 mol/(L·s)
②用物质B表示反应的平均速率为0.6 mol/(L·s)
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol/L
其中正确的是
| A.①③ | B.①④ | C.②③ | D.③④ |
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是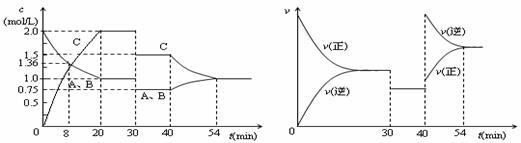
| A.第8min时 A的反应速率为0.08mol·L-1·min-1 |
| B.在0-54分钟的反应过程中该可逆反应的平衡常数始终为4 |
| C.30min时改变的条件是降低温度,40min时改变的条件是升高温度 |
| D.反应方程式中的x=1,且正反应为放热反应 |
一定条件下存在反应:C(s)+H2O(g) CO(g)+H2(g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
CO(g)+H2(g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
| 容器 |
甲 |
乙 |
 丙 丙 |
| 容积 |
0.5 L |
0.5 L |
V |
| 温度 |
T1 ℃ |
T2 ℃ |
T1 ℃ |
| 起始量 |
2 molC1 molH2O |
1 molCO 1 molH2 |
4 molC 2 molH2O |
下列说法正确的是
A.甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B.丙容器的体积V < 0.5 L
C.当温度为T1 ℃时,反应的平衡常数K=2.25
D.乙容器中,若平衡时n(H2O)=0.4 mol,则T1 < T2
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是
| A.2.5 μmol·L-1·min-1和2.0 μmol·L-1 |
| B.2.5 μmol·L-1·min-1和2.5 μmol·L-1 |
| C.3.0 μmol·L-1·min-1和3.0 μmol·L-1 |
| D.5.0 μmol·L-1·min-1和3.0 μmol·L-1 |
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3﹣+HSO3﹣→SO42﹣+Cl﹣+H+(未配平).已知该反应的速率随c(H+)的增大而加快.下列为用ClO3﹣在单位时间内物质的量浓度变化表示的该反应V﹣t图.下列说法中不正确的是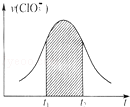
| A.反应开始时速率增大可能是c(H+)所致 |
| B.纵坐标为V(H+)的V﹣t曲线与图中曲线完全重合 |
| C.后期反应速率下降的主要原因是反应物浓度减小 |
| D.图中阴影部分“面积”可以表示t1﹣t2时间为c(Cl﹣)增加 |
下列说法中正确的是( )
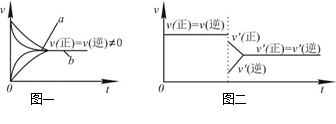
| A.Na2S2O3+2HCl==2NaCl+S↓+SO2↑+H2O在加热条件下化学反应速率增大的主要原因是该反应是吸热反应,加热使平衡向正反应方向移动 |
B.若在恒容容器中发生反应:N2+3H2 2NH3,达到平衡后再充入适量He,由于压强增大,化学平衡向正反应方向移动 2NH3,达到平衡后再充入适量He,由于压强增大,化学平衡向正反应方向移动 |
| C.在合成氨反应中,其他条件相同时,在有催化剂时(a)和无催化剂时(b)的速率—时间图像可用图一表示 |
D.若在恒压容器中发生反应:2SO3 2SO2+O2,达到平衡后再充入适量He,其速率—时间图像可用图二表示 2SO2+O2,达到平衡后再充入适量He,其速率—时间图像可用图二表示 |
以下是对化学反应变化过程及结果的研究。按要求回答问题:
Ⅰ.关于反应速率和限度的研究
(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25℃) |
1.8×10-5 |
4.9×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
则等物质的量浓度的①CH3COONa、②NaCN、③Na2CO3、④NaHCO3溶液的pH由大到小的顺序为__________(填编号)。
(2)已知2SO2(g)+O2(g)2SO3(g) ΔH=-196.6 kJ·mol-1,在一个容积为2 L的容器中加入2 mol SO2和1 mol O2,在某温度下充分反应,经过30 min达到平衡,放出热量176.94 kJ。如果用SO2表示该反应的反应速率,则v(SO2)=________。
(3)下图为某温度下,CuS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是________。
向新生成的ZnS浊液中滴入足量含相同浓度的Cu2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为________(填化学式)沉淀。
Ⅱ.关于电化学的研究
全钒液流电池是一种新型的绿色环保储能电池。其电池总反应为:VO2++2H++V2+ V3++VO2++H2O。则充电时阳极反应式为__________________________,用此电池电解1 L 1 mol·L-1的CuSO4溶液,当转移0.1 mol电子时,溶液的pH=________(不考虑溶液体积变化)。
V3++VO2++H2O。则充电时阳极反应式为__________________________,用此电池电解1 L 1 mol·L-1的CuSO4溶液,当转移0.1 mol电子时,溶液的pH=________(不考虑溶液体积变化)。
一定条件下,使X(g)与Y(g)在2L密闭容器中发生反应生成z(g)。温度为TK时,反应过程中X,Y,Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T, K和T2 K时,Y的体积分数与时间的关系如图2所示。则下列结论正确的是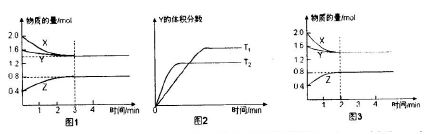
| A.反应进行的前3 min内,用X表示的反应速率V(X)=0.1 mol/(L·min) |
B.平衡时容器内的压强为反应前的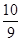 倍 倍 |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K减小 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
将2molA与2molB混合于2L的密闭容器中发生如下反应:2A(g)+3B(g)⇌2C(g)+zD(g),2s后A的转化率为50%,测得v(D)=0.25mol•L-1•s-1,下列推断不正确的是
A.v(C)=v(D)=0.25mol•L-1•s-1 B.z=2
C.B的转化率为25% D.C的体积分数为28.6%
向密闭容器中充入物质的量浓度均为 0.1 mol/L的CH4 和 CO2,在一定条件下发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是

| A.平衡时CO与H2的物质的量比为1:1 |
| B.p1、p2、p3、p4由大到小的顺序为p1<p2<p3<p4 |
| C.1100℃,p4条件下,该反应10 min时达到平衡点X,则ν(CO2) = 0.008 mol•L-1•min-1 |
| D.随着温度升高,该反应的平衡常数减小 |
一定温度时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,发生反应:PCl5(g)⇌Cl2(g)
+PCl3(g)经一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
下列说法正确的是
| A.反应在前50 s内的平均速率为v(PCl3)="0.0032" moI·L-l·s-l |
| B.保持其他条件不变,若升高温度,反应重新达到平衡,平衡时c(PCl3)=0.11moI·L-l, 则正反应的△H<0 |
| C.相同温度下,若起始时向容器中充入1.0 molPCl5、0.20mol PCl3和0.20 mol Cl2,则反应达到平衡前v(正)<v(逆) |
| D.相同温度下,若起始时向容器中充入1.0mol PCl3、1.0 mol Cl2,则反应达到平衡时PCl3的转化率为80% |
试题篮
()