将等物质的量的A、B混合于2L密闭容器中发生如下反应:3A(g)+B(g)=xC(g)+2D(g),经5分钟后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5, C的平均反应速率是0.1mol/(L.min)求:
(1)此时A的浓度为 ,反应开始前容器中B的物质的量为 。
(2)B的平均反应速率为 。
(3)x= 。
有一化学反应2A B+D ,B、D起始浓度为0,在四种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空:
B+D ,B、D起始浓度为0,在四种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空:
| 实验 序号 |
浓度(mol/L) |
时间(min) |
|||||||
| 0 |
10 |
20 |
30 |
40 |
50 |
60 |
|||
| 1 |
温度 |
800 ℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800 ℃ |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
| 3 |
800 ℃ |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
(1)在实验1,反应在0至40分钟时间内A的平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度C2= mol/L,可推测实验2中隐含的条件是
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则达到平衡时v3 v1(填>、=、<=,)800℃时,反应平衡常数= ,且C3= mol/L,可推测实验3中隐含的条件是 。
(4)800℃时,反应B+D  2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0,达到平衡时A的浓度为 mol/L, B的转化率= 。
2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0,达到平衡时A的浓度为 mol/L, B的转化率= 。
氮的化合物是中学化学的重要物质,与人类生活密切相关。
(1)金属与不同密度的硝酸溶液反应所得的还原产物比较复杂,如图所示:
请写出铁与密度为1.35 g.m 的硝酸反应的化学方程式:______________________.
的硝酸反应的化学方程式:______________________.
(2)亚硝酸钠是一种致癌物质,它在中性或碱性条件下是稳定的,酸化后能氧化碘化钾生成棕色溶液和NO,则该反应中氧化剂与还原剂的物质的量之比为____。
(3)如图甲为NO2和C0反应生成CO2和NO过程的能量变化示意图,请写出该反应的热化学方程式:__________________________________________________________.
(4)已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g) △H<0。现将一定量的NO2和N2O4混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物的浓度随时问变化关系如图乙所示。
N2O4(g) △H<0。现将一定量的NO2和N2O4混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物的浓度随时问变化关系如图乙所示。
①前10 min内用NO2表示的平均反应速率v(NO2)= ;上述反应的平衡常数K=__________。
②反应进行至25 min时,曲线发生变化的原因是________________________.
③若要使上述反应的平衡常数K增大,采取的措施是_________________。
| A.加入催化剂 | B.缩小容器体积 | C.降低温度 | D.再加入一定量的NO2 |
(1)在一定条件下,容积为 10L密闭容器中发生反应:CH4(g)+H2O(g)  CO(g)+3H2(g);ΔH>0,将1.0 mol CH4和2.0 mol H2O(g)通入该密闭容器10 min时有0.1 mol CO生成,则10 min内该反应的平均速率υ(H2) 。
CO(g)+3H2(g);ΔH>0,将1.0 mol CH4和2.0 mol H2O(g)通入该密闭容器10 min时有0.1 mol CO生成,则10 min内该反应的平均速率υ(H2) 。
(2)在压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇: CO(g)+2H2(g)  CH3OH(g) 平衡时CO的转化率与温度、压强的关系如图。
CH3OH(g) 平衡时CO的转化率与温度、压强的关系如图。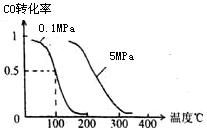
①该反应的△H 0 (填“<”、“>”或“=”)。
②100℃时该反应的平衡常数K= (用含a、V的代数式表示)。
③在温度容积不变的情况下,向该密闭容器再增加a mol CO与 2a mol H2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”)。平衡常数 (填“增大”、“减小”或“不变”)
④在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2反应生成CH3OH(g),达到平衡时CO的转化率为80%,此时容器内的压强为开始时的 倍。
将等物质的量的H2和I2充入体积为2 L的密闭容器中,进行反应:H2(g)+ I2(g) 2HI(g),测得2min内v (HI)= 0.1 mol•L-1•min-1,2min 后I2(g)的浓度为0.4 mol•L-1,试确定:
2HI(g),测得2min内v (HI)= 0.1 mol•L-1•min-1,2min 后I2(g)的浓度为0.4 mol•L-1,试确定:
(1)2min内以H2所表示的反应速率为___________________;
(2)I2的起始物质的量为___________________;
(3)2min末HI的浓度为___________________
(10分,每空2分)自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:
SiO2(s) +4HF(g) SiF4(g)+ 2H2O(g) △H1=-48.9 kJ·mol-1
SiF4(g)+ 2H2O(g) △H1=-48.9 kJ·mol-1
根据题意完成下列填空:
(1)在地壳深处容易有 气体逸出,在地壳浅处容易有 沉积。
(2)如果上述反应的平衡常数K值变大,该反应 (选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,不正确的 (选填编号)。
a.2v正(HF)=v逆(H2O) b.v(H2O)=2v(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为 。
将等物质的量A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经5分钟后,测得D的浓度为0.5mol/L,且c(A) : c(B)="3" : 5,C的平均反应速率是0.1mol/(L﹒min)。求:
xC(g)+2D(g),经5分钟后,测得D的浓度为0.5mol/L,且c(A) : c(B)="3" : 5,C的平均反应速率是0.1mol/(L﹒min)。求:
(1)反应开始前放入容器中A的物质的量为 (2)B的平均反应速率为
(3)x值为
某温度时,在2 L的密闭容器中,M、N两种物质的量随时间的变化曲线如下图所示。
(1)达到平衡时N的转化率是
(2)由图中所给数据进行分析,该反应的化学方程式为 ;
(3)若t2=2,则反应从开始至2分钟末,用M的浓度变化表示的平均反应速率为 v(M)= ;
将4 mol A气体和2 mol B气体在2L 的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)  2C(g)若经2s 后测得C的浓度为0.6mol•L-1,那么,
2C(g)若经2s 后测得C的浓度为0.6mol•L-1,那么,
(1)用物质A表示的反应的平均速率为 ,
用物质B 表示的反应的平均速率为 。
(2)2s时物质B的浓度为 ,
2s时物质A的转化率为 。
有一化学反应2A  B+D ,B、D起始浓度为0,在三种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空:
B+D ,B、D起始浓度为0,在三种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空: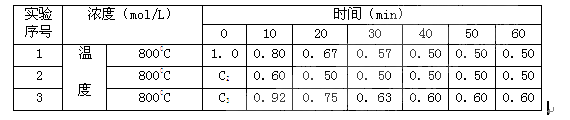
(1)在实验1,反应在0至20分钟时间内A的平均速率为_______mol/(L·min)。
(2)在实验2,A的初始浓度C2=____________mol/L,可推测实验2中隐含的条件是___________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则达到平衡时v3 v1(填>、=、<=,)800℃时,反应平衡常数= ,且C3=_______mol/L,可推测实验3中隐含的条件是___________。
(4)800℃时,反应B+D  2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0, 达到平衡时A的浓度为 mol/L, B的转化率= 。
2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0, 达到平衡时A的浓度为 mol/L, B的转化率= 。
(15分)已知2A(g)+B(g) 2C(g),H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。
2C(g),H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。
⑴比较a b(填“>”“=”或“<”)。
⑵下表为不同温度下该反应的平衡常数。由此可推知,表中T1 T2(填“>”、“=”或“<”)。
| T/K |
T1 |
T2 |
T3 |
| K |
1.00×107 |
2.45×105 |
1.88×103 |
若在原来的容器中,只加入2 mol C,500 ℃时充分反应达平衡后,吸收热量为c kJ,C的浓度 (填“>”“=”或“<”)ωmol/L,a、b、c之间满足何种关系 (用代数式表示)。
⑶ 在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是 。
A. 4 mol A和2 mol B B. 4 mol A、2 mol B和2 mol C
C. 4 mol A和4 mol B D. 6 mol A和4 mol B
⑷为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
A. 及时分离出C气体 B. 适当升高温度
C. 增大B的浓度 D. 选择高效催化剂
⑸ 若将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol A和1 mol B,500 ℃时充分反应达平衡后,放出热量为d kJ,则d b(填“>”、“=”或“<”),理由是_ 。
⑹ 在一定温度下,向一个容积可变的容器中,通入3 mol A和2 mol B及固体催化剂,使之反应,平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol A、3 mol B和2 mol C,则平衡时A的百分含量 (填“不变”、“变大”、“变小”或“无法确定”)。
A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1 mol•L-1。反应进行2min
后A的浓度为0.8 mol•L-1,B的浓度为0.6 mol•L-1,C的浓度为0.6 mol•L-1。则2min内反应的平
均速率υ(A)=____________, υ(B)=_________________,υ(C)=_______________。 该反应的化学
反应方程式为:_____________________________。
在450℃并有催化剂存在下,在体积为1L的密闭恒温容器中,二氧化硫和氧气发生如下反应:2SO2+ O2  2SO3
2SO3 
(1)已知:64g SO2完全转化为SO3会放出85kJ热量。 SO2转化为SO3的热化学方程式是 。
(2)该反应的化学平衡常数表达式K= 。
(3)降低温度,化学反应速率 。该反应K值将 。(填“增大”或“减小”或“不变”)
(4)450℃时,在一密闭容器中,将二氧化硫与氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间段是 。
a.10-15min b.15-20min c.20-25min d.25-30min
(5)据图判断,10min到15min的曲线变化的原因可能是 (填写编号)。
a.增加SO3的物质的量 b.增大容器体积 c.降低温度 d.催化剂
(6)在15分钟时,SO2的转化率是 。
(10分)(1)某温度时,在2 L容器中,X、Y、Z三种物质的物质的量随时间变化曲线图所示。由图中数据分析,该反应的化学方程式为:______________________________________________________
反应开始至2 min,Z的平均反应速率为 __________________。
(2)不同时间测得以下反应速率:①v(X)=0.075mol/(L·min)
②v(Y)=0.001mol/(L·s) ③v(Z)=0.06mol/(L·min)
速率由大到小关系正确为: (填编号)
(3)可逆反应:
aA(g)+bB(g)  cC(g)+dD(g)的v-t图像如图所示:
cC(g)+dD(g)的v-t图像如图所示:
①其阴影面积表示的是________________________________
②若其他条件都不变,只是在反应前加入合适的催化剂,则阴影面积将________(填变大、不变或变小)
.联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。(1)已知:2NO2(g) N2O4(g),N2O4为无色气体。
N2O4(g),N2O4为无色气体。
① 在上述条件下反应能够自发进行,则反应的ΔH 0(填写“>”、“<”、“=”)
② 一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡,达到平衡状态的标志 。
N2O4(g)达到平衡,达到平衡状态的标志 。
A单位时间内生成n mol N2O4的同时生成2 nmolNO2
B用NO2、N2O4的物质的量浓度变化表示的反应速率之比为2:1的状态
C混合气体的颜色不再改变的状态
D混合气体的密度不再改变的状态
E混合气体的平均相对分子质量不再改变的状态
③ 其他条件不变时,下列措施能提高NO2转化率的是 (填字母)
| A.减小NO2的浓度 | B.降低温度 | C.增大压强 | D.升高温度 |
(2)25℃时,1molN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放612.5 kJ的热量。请写出该反应的热化学方程式: 。
(3) 17℃、1.01×105Pa,往10L密闭容器中充入NO2,达到平衡时,c(NO2)="0.2" mol·L-1,
c(N2O4)="0.16" mol·L-1。则反应初始时,充入NO2的物质的量为 ;NO2的转化率为 ;该温度下该反应的平衡常数K为 ;该温度下反应N2O4(g)  2NO2(g)的平衡常数K为 。
2NO2(g)的平衡常数K为 。
试题篮
()