现有反应:mA(g)+ B(g) 2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:
2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:
(1)该反应的△H 0(填“>”或“<”),且m 1(填“>”“=”“<”)。
(2)若加入B(假设容器的体积不变),则A的转化率 ,B的转化率 。(填“增大”“减小”或“不变”)
(3)若B是有色物质,A、C均无色,则加入C(假设容器的体积不变)时混合物颜色 ,
若维持容器内压强不变,充入氖气时,混合物颜色 (填“变深”“变浅”或“不变”)。
(4)一定温度下,向1L密闭容器中加入1mol C(g)使其分解,气体A的物质的量随时间的变化如下图所示。
则0~2 min内的平均反应速率υ(C)= 。
(12分)在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g)  2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
(1)该温度下,若温度升高,K值将________(填“增大”、“减小”或“不变”)。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的是________点。从起点开始首次达到平衡时,以NO2表示的反应速率为____________。
(3)25 min时,加入了__________(填加入物质的化学式及加入的物质的量),使平衡发生了移动。
(4)d点对应NO2的物质的量浓度________(填“大于”、“小于”或“等于”)0.8 mol·L-1,理由是_______________________________________________________________________。
(1)氢气可由天然气和水反应制备,其主要反应为:
CH4(g)+ 2H2O(g)  CO2(g)+4H2(g)
CO2(g)+4H2(g)
反应过程中能量变化如图所示:
则该反应为 反应(填“吸热”或“放热”)。若已知,破坏1mol化学键需要吸收的热量如下代数式表示:
| 化学键 |
C—H |
O—H |
C=O |
H—H |
| 吸收热量(kJ/mol) |
a |
b |
c |
d |
则根据该反应制取1mol H2要吸收或放出热量为 kJ(用含a b c d字母表示)。
(2)某温度下,10L密闭容器中充入1.8mol CH4和3mol H2O(g),发生CH4+2H2O(g)  CO2+4H2反应,反应进行到8s时CO2的浓度为0.08mol/L,则:
CO2+4H2反应,反应进行到8s时CO2的浓度为0.08mol/L,则:
①前8s以H2O(g)表示的平均反应速率为 ;
②8s时,混合气体中H2的体积分数为 ;
(8分)某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:
(1)该反应的化学方程式为____________________________________。
(2)反应开始至4 min时,A的平均反应速率为____________________________。
(3)4 min时,反应是否达到平衡状态?________(填“是”或“否”), 8 min时,v(正)________v(逆)(填“>”、“<”或“=”)。
某学生为了探究足量的锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL,标况下) |
50 |
120 |
232 |
290 |
310 |
(1)假设用V1、V2、V3、V4、V5依次表示0~1、1~2、2~3、3~4、4~5每分钟内的反应速率,则速率由大到小的排列顺序为 。
(2)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率V3= 。
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是(填编号) 。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间的变化关系曲线如图所示。
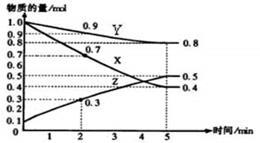
(1)由图中的数据分析,该反应的化学方程式为 ___________
(2)反应开始至2min、5minZ的平均反应速率为 、 ;
(3)5min后Z的生成速率比5min末Z的生成速率 (填写“大、小或相等”)。
将等物质的量的A、B混合于2L密闭容器中发生如下反应:3A(g)+B(g)=xC(g)+2D(g),经5分钟后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5, C的平均反应速率是0.1mol/(L.min)求:
(1)此时A的浓度为 ,反应开始前容器中B的物质的量为 。
(2)B的平均反应速率为 。
(3)x= 。
有一化学反应2A B+D ,B、D起始浓度为0,在四种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空:
B+D ,B、D起始浓度为0,在四种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空:
| 实验 序号 |
浓度(mol/L) |
时间(min) |
|||||||
| 0 |
10 |
20 |
30 |
40 |
50 |
60 |
|||
| 1 |
温度 |
800 ℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800 ℃ |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
| 3 |
800 ℃ |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
(1)在实验1,反应在0至40分钟时间内A的平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度C2= mol/L,可推测实验2中隐含的条件是
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则达到平衡时v3 v1(填>、=、<=,)800℃时,反应平衡常数= ,且C3= mol/L,可推测实验3中隐含的条件是 。
(4)800℃时,反应B+D  2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0,达到平衡时A的浓度为 mol/L, B的转化率= 。
2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0,达到平衡时A的浓度为 mol/L, B的转化率= 。
(1)在一定条件下,容积为 10L密闭容器中发生反应:CH4(g)+H2O(g) 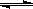 CO(g)+3H2(g);ΔH>0,将1.0 mol CH4和2.0 mol H2O(g)通入该密闭容器10 min时有0.1 mol CO生成,则10 min内该反应的平均速率υ(H2) 。
CO(g)+3H2(g);ΔH>0,将1.0 mol CH4和2.0 mol H2O(g)通入该密闭容器10 min时有0.1 mol CO生成,则10 min内该反应的平均速率υ(H2) 。
(2)在压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇: CO(g)+2H2(g)  CH3OH(g) 平衡时CO的转化率与温度、压强的关系如图。
CH3OH(g) 平衡时CO的转化率与温度、压强的关系如图。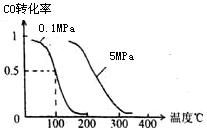
①该反应的△H 0 (填“<”、“>”或“=”)。
②100℃时该反应的平衡常数K= (用含a、V的代数式表示)。
③在温度容积不变的情况下,向该密闭容器再增加a mol CO与 2a mol H2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”)。平衡常数 (填“增大”、“减小”或“不变”)
④在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2反应生成CH3OH(g),达到平衡时CO的转化率为80%,此时容器内的压强为开始时的 倍。
将等物质的量的H2和I2充入体积为2 L的密闭容器中,进行反应:H2(g)+ I2(g) 2HI(g),测得2min内v (HI)= 0.1 mol•L-1•min-1,2min 后I2(g)的浓度为0.4 mol•L-1,试确定:
2HI(g),测得2min内v (HI)= 0.1 mol•L-1•min-1,2min 后I2(g)的浓度为0.4 mol•L-1,试确定:
(1)2min内以H2所表示的反应速率为___________________;
(2)I2的起始物质的量为___________________;
(3)2min末HI的浓度为___________________
(10分,每空2分)自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:
SiO2(s) +4HF(g) SiF4(g)+ 2H2O(g) △H1=-48.9 kJ·mol-1
SiF4(g)+ 2H2O(g) △H1=-48.9 kJ·mol-1
根据题意完成下列填空:
(1)在地壳深处容易有 气体逸出,在地壳浅处容易有 沉积。
(2)如果上述反应的平衡常数K值变大,该反应 (选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,不正确的 (选填编号)。
a.2v正(HF)=v逆(H2O) b.v(H2O)=2v(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为 。
将等物质的量A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经5分钟后,测得D的浓度为0.5mol/L,且c(A) : c(B)="3" : 5,C的平均反应速率是0.1mol/(L﹒min)。求:
xC(g)+2D(g),经5分钟后,测得D的浓度为0.5mol/L,且c(A) : c(B)="3" : 5,C的平均反应速率是0.1mol/(L﹒min)。求:
(1)反应开始前放入容器中A的物质的量为 (2)B的平均反应速率为
(3)x值为
某温度时,在2 L的密闭容器中,M、N两种物质的量随时间的变化曲线如下图所示。
(1)达到平衡时N的转化率是
(2)由图中所给数据进行分析,该反应的化学方程式为 ;
(3)若t2=2,则反应从开始至2分钟末,用M的浓度变化表示的平均反应速率为 v(M)= ;
将4 mol A气体和2 mol B气体在2L 的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)  2C(g)若经2s 后测得C的浓度为0.6mol•L-1,那么,
2C(g)若经2s 后测得C的浓度为0.6mol•L-1,那么,
(1)用物质A表示的反应的平均速率为 ,
用物质B 表示的反应的平均速率为 。
(2)2s时物质B的浓度为 ,
2s时物质A的转化率为 。
有一化学反应2A  B+D ,B、D起始浓度为0,在三种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空:
B+D ,B、D起始浓度为0,在三种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空: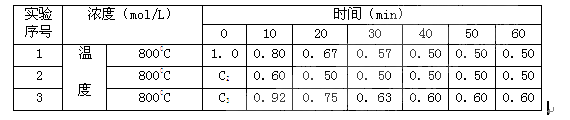
(1)在实验1,反应在0至20分钟时间内A的平均速率为_______mol/(L·min)。
(2)在实验2,A的初始浓度C2=____________mol/L,可推测实验2中隐含的条件是___________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则达到平衡时v3 v1(填>、=、<=,)800℃时,反应平衡常数= ,且C3=_______mol/L,可推测实验3中隐含的条件是___________。
(4)800℃时,反应B+D  2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0, 达到平衡时A的浓度为 mol/L, B的转化率= 。
2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0, 达到平衡时A的浓度为 mol/L, B的转化率= 。
试题篮
()