(1)如果反应物所具有的总能量大于生成物所具有的总能量,反应物转化为生成物时 (填吸收或放出)热量,△ H (填大于或小于)0;
(2)对于反应2SO2 + O2 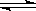 2SO3 其它条件不变,只改变一个反应条件,将生成SO3的反应速率的变化填入表中空格里 。(填字母 A.增大 B.减小 C.不变)
2SO3 其它条件不变,只改变一个反应条件,将生成SO3的反应速率的变化填入表中空格里 。(填字母 A.增大 B.减小 C.不变)
| 改变条件 |
速率变化 |
||
| 降低温度 |
|
||
| 增大O2的浓度 |
|
||
| 使用V2O5做催化剂 |
|
||
| 压缩气体 |
|
一定温度下,反应N2(g)+O2(g) 2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是( )
2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是( )
| A.缩小体积使压强增大 | B.恒容,充入N2 |
| C.恒容,充入He | D.恒压,充入He |
已知反应 ,达平衡时,要使c(A)增大同时使v(正)增大,应改变的条件为
,达平衡时,要使c(A)增大同时使v(正)增大,应改变的条件为
A.减小容器容积 B.增大容器容积
C.减小B的浓度 D.降温
硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是
| 实验 |
反应温度/℃ |
Na2S2O3溶液 |
稀H2SO4 |
H2O |
||
| V/ml |
c/(mol·L—1) |
V/ml |
c/(mol·L—1) |
V/mL |
||
| A |
25 |
5 |
0.1 |
10 |
0.1 |
5 |
| B |
25 |
5 |
0.2 |
5 |
0.2 |
10 |
| C |
35 |
5 |
0.1 |
10 |
0.1 |
5 |
| D |
35 |
5 |
0.2 |
5 |
0.2 |
10 |
在气体反应中,能使反应物中活化分子浓度和活化分子百分数同时增大的方法是
①增大反应物的浓度 ②升高温度 ③增大压强 ④移去生成物 ⑤加入催化剂
| A.①③⑤ | B.②⑤ | C.②③⑤ | D.①③④ |
对于反应2SO2+O2 2SO3,下列变化可增大活化分子百分数而使反应速率加快的是
2SO3,下列变化可增大活化分子百分数而使反应速率加快的是
①增大压强 ②升高温度 ③增大O2浓度 ④使用催化剂
| A.①③ | B.①④ | C.②③ | D.②④ |
下列各条件下发生反应X+Y=XY时,速率最快的是
| A.常温下,20mL中含X、Y各0.003mol的溶液 |
| B.常温下,100mL中含X、Y各0.005mol的溶液 |
| C.常温下,0.1mol/L的X、Y溶液各l0mL相混合 |
| D.标准状况下,0.1mol/L的X、Y溶液各l0mL相混合 |
一定温度下,取pH=12的NaOH溶液和氨水各10 mL,分别用蒸馏水冲稀至1 L。关于稀释后的溶液的pH的说法正确的是
| A.NaOH溶液的pH小于氨水的pH | B.NaOH溶液的pH大于氨水的pH |
| C.两溶液的pH相等 | D.无法判别两溶液pH的相对大小 |
在生产、生活中为增大反应速率而采取的措施合理的是
| A.食物放在冰箱中 |
| B.塑料制品中添加抑制剂 |
| C.在糕点包装内放置小包除氧剂 |
| D.燃煤发电时用煤粉代替煤块 |
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的
①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液
| A.②④⑥ | B.①② | C.②③⑤ | D.②④⑤⑥ |
设C+CO2 2CO △H>0反应速率为V1,N2+3H2
2CO △H>0反应速率为V1,N2+3H2 2NH3△H<0 反应速率为V2,对于上述反应,当温度升高时,V1和V2的变化情况为( )
2NH3△H<0 反应速率为V2,对于上述反应,当温度升高时,V1和V2的变化情况为( )
| A.同时增大 | B.同时减小 | C.V1增大,V2减小 | D.V1减小,V2增大 |
下列说法正确的是
| A.自发反应在任何条件下都能实现 |
| B.化学反应不一定都有能量变化 |
| C.升高温度,活化分子百分数增大,化学反应速率一定增大 |
| D.一般使用催化剂可以降低反应的活化能,增大活化分子百分数,从而提高反应物的转化率 |
相同质量的锌与酸反应制备H2,欲使反应速率最大,下列条件下的最佳组合是
①纯锌片②粗锌粒③0.1mol·L-1硫酸④98%的浓硫酸⑤加热⑥用冰水冷却
| A.①④⑤ | B.②③⑤ | C.①③⑥ | D.②④⑤ |
下列说法正确的是
| A.放热反应一定不需要加热 |
| B.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
| C.使用催化剂不但能加快反应速率,而且可以让不可能发生的反应发生 |
| D.难溶物也可能是强电解质 |
试题篮
()