对于在同一容器中进行的反应C+O2=CO2,下列说法不正确的是
| A.将碳块磨成粉末可以加快反应速率 |
| B.升高温度一般可以加快反应速率 |
| C.容器体积不变时,向其中充入N2,反应速率不变 |
| D.增加碳的量可以加快反应速率 |
在四个试管中,发生如下反应:Zn+H2SO4=ZnSO4+H2↑,产生H2的速率最快的是
| 试管 |
硫酸浓度 |
温度 |
Zn的状态 |
| A |
1mol·L-1 |
20℃ |
块 状 |
| B |
1mol·L-1 |
20℃ |
粉末状 |
| C |
2mol·L-1 |
50℃ |
块 状 |
| D |
2mol·L-1 |
50℃ |
粉末状 |
把镁条投入到盛有盐酸的敞口容器里,产生H2的速率可由右图表示。在下列因素中:①盐酸的浓度;②镁条的表面积;③溶液的温度;④Cl-的浓度;影响反应速率的因素是
| A.①④ | B.③④ | C.①②③ | D.②③ |
设C+CO2 = 2CO(正反应吸热),反应速率为v1;N2+3H2 =2NH3(正反应放热),反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为
| A.同时增大 | B.同时减小 | C.v1增加,v2减小 | D.v1减小,v2增大 |
100mL6mol/LH2SO4跟过量的锌粉反应,在一定温度下,为了减缓反应速率,但又不影响生成氢气的总量。加入下列物质不能达到上述目的的是
| A.把锌粉改为锌粒 | B.水 | C.碳酸钠(固体) | D.降低反应体系温度 |
下列说法正确的是
| A.对于有气体参与的反应,增大压强,活化分子总数增多,化学反应速率增大 |
| B.对放热反应而言,升高温度,活化分子百分数减少,化学反应速率减小 |
| C.活化分子间发生的碰撞为有效碰撞 |
| D.使用催化剂,活化分子百分数增多,化学反应速率增大 |
从下列实验事实所得出的相应结论正确的是
| 选项 |
实验事实 |
结论 |
| A |
Na2S2O3溶液与稀硫酸反应,其他条件相同,Na2S2O3溶液浓度越大,析出硫沉淀所需时间越短 |
当其他条件不变时,增大反应物浓度,化学反应速率加快 |
| B |
在化学反应前后,催化剂的质量和化学性质都没有发生变化 |
催化剂一定不参与化学反应 |
| C |
H+浓度相同的盐酸和醋酸分别与等质量的形状相同的锌反应 |
前者速率快 |
| D |
在容积可变的密闭容器中发生反应H2(g)+I2(g) 2HI(g),把容积缩小一半 2HI(g),把容积缩小一半 |
正反应速率加快,逆反应速率不变 |
已知:4NH3 (g)+5O2 (g) 4NO (g)+6H2O (g) ΔH=-1 025kJ/mol,若反应起始物质的量相同,下列关于该反应的示意图不正确的是:
4NO (g)+6H2O (g) ΔH=-1 025kJ/mol,若反应起始物质的量相同,下列关于该反应的示意图不正确的是:

对已达化学平衡的下列反应 2X(g)+Y(g)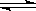 2Z(g),减小压强时,对反应产生的影响是:
2Z(g),减小压强时,对反应产生的影响是:
| A.逆反应速率增大,正反应速率减小 |
| B.逆反应速率减小,正反应速率增大 |
| C.逆反应速率先增大后减小 |
| D.正反应速率先减小后增大 |
对于可逆反应:2SO2+O2 2SO3,下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是:
2SO3,下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是:
| A.增大压强 | B.升高温度 | C.使用催化剂 | D.充入O2 |
对可逆反应:A(g)+3B(g)  2C(g) ∆H <0,下列叙述错误的是
2C(g) ∆H <0,下列叙述错误的是
| A.升高温度平衡逆向移,v(正)、v(逆)都增大,但v(逆)增的更大 |
| B.增大压强平衡正移,v(正)、v(逆)都增大,但v(正)增的更大 |
| C.增大A的浓度平衡正移,v(正)会增大,但v(逆)会减小 |
| D.采用催化剂一般v(正)、v(逆)同时增大,而且增大的倍数相同 |
下图为可逆反应A(g)+2B(g) nC(g)(正反应放热)生成物C的浓度随压强变化并建立平衡的关系图,则n值与压强p1、p2的关系正确的是
nC(g)(正反应放热)生成物C的浓度随压强变化并建立平衡的关系图,则n值与压强p1、p2的关系正确的是
| A.p2>p1,n<3 |
| B.p2>p1,n>3 |
| C.p1>p2,n<3 |
| D.p1>p2,n>3 |
反应A+B C的反应速率方程式为:v=k·c(A)·c(B),v为反应速率,k为速率常数只与温度有关。当c(A)=c(B)=1 mol/L时,反应速率在数值上等于速率常数。下列说法正确的是
C的反应速率方程式为:v=k·c(A)·c(B),v为反应速率,k为速率常数只与温度有关。当c(A)=c(B)=1 mol/L时,反应速率在数值上等于速率常数。下列说法正确的是
A.c(A)增大时,v增大,k也增大 B.c(B)增大时,v增大,k值不变
C.升高温度时,v增大,k值不变 D.升高温度时,v值不变,k增大
下列有关化学反应速率的说法中,正确的是
| A.100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 |
| B.用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 |
| C.二氧化硫的催化氧化是一个放热反应,升高温度,平衡逆向移动,正反应速率减慢 |
| D.汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,加入催化剂,不影响CO的转化率 |
试题篮
()