把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由如图表示,在下列因素中,①盐酸的浓度,②镁条的表面积, ③溶液的温度,④氯离子的浓度,影响反应速率的因素是
| A.①④ | B.③④ | C.②③ | D.①②③ |
下列说法正确的是
| A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 |
| B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大单位体积内活化分子的数目,有效碰撞次数增大,化学反应速率增大 |
| C.升高温度能使化学反应速率增大,唯一的原因是增加了反应物分子中活化分子的百分数 |
| D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率 |
下列说法正确的是
| A.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率 |
| B.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 |
| C.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 |
| D.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 |
下列说法中有明显错误的是
| A.对有气体参加的化学反应,增大压强,体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大 |
| B.活化分子之间发生的碰撞一定为有效碰撞 |
| C.升高温度,一般可使活化分子的百分数增大,因而反应速率增大 |
| D.加适宜的催化剂,可使活化分子的百分数大大增加,从而增大反应速率 |
根据反应:S2O32﹣+2H+═SO2+S↓+H2O,下表各组实验最快出现浑浊的是
| |
Na2S2O3溶液 |
稀H2SO4 |
H2O |
温度/℃ |
||
| c(mol·L﹣1) |
V(mL) |
c(mol·L﹣1) |
V(mL) |
V(mL) |
||
| A |
0.1 |
5 |
0.1 |
5 |
5 |
10 |
| B |
0.2 |
5 |
0.1 |
5 |
10 |
10 |
| C |
0.1 |
5 |
0.1 |
5 |
10 |
30 |
| D |
0.2 |
5 |
0.1 |
5 |
10 |
30 |
已知2SO2(g) + O2(g) 2SO3(g)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法不正确的是
2SO3(g)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法不正确的是
| A.若升高温度,可以加快反应速率 |
| B.使用催化剂是为了加快反应速率 |
| C.在上述条件下,SO2不能完全转化为SO3 |
| D.达到平衡时,SO2的浓度与SO3的浓度相等 |
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
| A.加热 |
| B.不用稀硫酸,改用98%的浓硫酸 |
| C.滴加少量CuSO4溶液 |
| D.不用铁片,改用铁粉 |
反应:A(气)+3B(气) 2C(气); ΔH < 0 达平衡后,将气体混合物的温度降低,下列叙述中正确的是
2C(气); ΔH < 0 达平衡后,将气体混合物的温度降低,下列叙述中正确的是
| A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动 |
| B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动 |
| C.正反应速率和逆反应速率都变小,平衡向正反应方向移动 |
| D.正反应速率和逆反应速率都变小,平衡向逆反应方向移动 |
下列说法正确的是
A.用右图所示方法可保护钢闸门不被腐蚀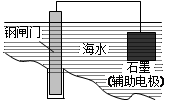 |
| B.SiO2(s)+2C(s)=Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0 |
C.常温下,NH4Cl溶液加水稀释,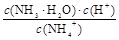 增大 增大 |
D.C(s)+H2O(g) CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 |
反应C(s)+H2O(g)  CO(g) + H2(g) 在一可变容积的密闭容器中进行,下列条件的改变能使瞬间正反应速率增大的是
CO(g) + H2(g) 在一可变容积的密闭容器中进行,下列条件的改变能使瞬间正反应速率增大的是
| A.增加碳单质的量 |
| B.保持体积不变,充入N2使体系压强增大 |
| C.将容器的体积缩小一半 |
| D.保持压强不变,充入N2使体系体积增大 |
在一定条件下,可逆反应N2(g)+3H3(g) 2NH3(g) ΔH<0达到平衡,当单独改变下列条件后,有关叙述错误的是
2NH3(g) ΔH<0达到平衡,当单独改变下列条件后,有关叙述错误的是
| A.加催化剂,v(正)、v(逆)都发生变化,且变化的倍数相等 |
| B.加压,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数 |
| C.降温,v(正)、v(逆)都减小,且v(正)减小的倍数小于v(逆)减小的倍数 |
| D.加入氩气,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数 |
在密闭容器中进行反应:A(g)+3B(g)⇌2C(g),有关下列图象说法的不正确的是
| A.依据图a可判断正反应为放热反应 |
| B.在图b中,虚线可表示使用了催化剂 |
| C.若正反应的△H<0,图c可表示升高温度使平衡向逆反应方向移动 |
| D.由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的△H>0 |
(14分,每空2分)下表是稀硫酸与某金属反应的实验数据:
| 实验 |
金属 |
金属 |
C(H2SO4) |
V(H2SO4) |
溶液温度/℃ |
金属消失 |
|
| 序号 |
质量/g |
状态 |
/mol·L-1 |
/mL |
反应前 |
反应后 |
的时间/s |
| 1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
| 2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
| 3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
| 4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
| 5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
| 6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
| 7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
| 8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
| 9 |
0.10 |
丝 |
1.1 |
50 |
30 |
44 |
40 |
分析上述数据,回答下列问题:
(1)实验4和5表明,___________对反应速率有影响,____________反应速率越快,能表明同一规律的实验还有____________(填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有 ____ (填实验序号);
(3)本实验中影响反应速率的其他因素还有 ________ ,其实验序号是 ____ 。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因: 。
试题篮
()