下列物质的水溶液:①NaOH、②CH3COOH、③NH3,④NaHCO3、⑤Cl2,不能溶解CaCO3的是
| A.①③④ | B.①④⑤ | C.②④ | D.②⑤ |
已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-11。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010 mol/L,向该溶液中逐滴加入0.010 mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为 ( )
| A.Cl-、Br-、CrO42- | B.CrO42-、Br、Cl- |
| C.Br-、Cl-、CrO42- | D.Br、CrO42-、Cl- |
下列说法不正确的是
| A.化学反应是旧键断裂和新键形成的过程 |
| B.盖斯定律实质上是能量守恒定律的体现 |
| C.反应前后分子数不变遵循的是质量守恒定律 |
| D.溶解平衡、水解平衡和电离平衡均为动态平衡 |
已知t ℃时的Ksp (AgC1) =1.6×10-10,Ksp (AgBr )=7.8×10-13;在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是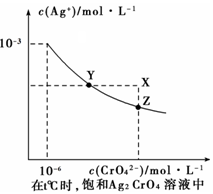
| A.t℃时,Ksp (Ag2CrO4 )=1×10-9 |
| B.t℃时,在饱和Ag2CrO4溶液中加入AgNO3可使溶液由Z点到X点 |
| C.t℃时,溶解度的大小顺序为AgC1 > Ag2CrO4>AgBr |
| D.t℃时,取一定量的KCl和KBr的混和溶液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,c(C1-)/c(Br-)= Ksp (AgC1)/ Ksp (AgBr) |
常温下,往饱和石灰水中加入一定量的生石灰,一段时间后恢复到原温度,以下叙述错误的是
| A.有溶质析出 | B.溶液中Ca2+的数目不变 |
| C.溶剂的质量减小 | D.溶液的pH不变 |
已知某温度下CH3COOH和NH3•H2O 的电离常数相等,现向10mL浓度为0.1mol•L‾1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中下列说法正确的是
| A.水的电离程度始终增大 |
| B.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO‾) |
| C.c(CH3COOH)与c(CH3COO‾)之和始终保持不变 |
| D.c(NH4+)/c(NH3•H2O)先增大再减小 |
下列有关沉淀溶解平衡的说法正确的是
A.Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度
B.在AgCl的沉淀溶解平衡体系中,加入蒸馏水,AgCl的Ksp增大
C.在AgI的沉淀溶解平衡体系中,加入K2S固体,AgI沉淀可转化为Ag2S沉淀
D.在CaCO3的沉淀溶解平衡体系中,通入CO2气体,溶解平衡不移动
25℃时,Ksp(AgCl)=1.56×10﹣10,Ksp(Ag2CrO4)=9.0×10﹣12,下列说法正确的是( )
| A.向同浓度的Na2CrO4和NaCl混合溶液中滴加AgNO3溶液,AgCl先析出 |
| B.向AgCl饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl﹣) |
C.AgCl和Ag2CrO4共存的悬浊液中,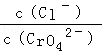 = =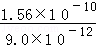 |
| D.向Ag2CrO4的悬浊液中加入NaCl浓溶液,Ag2CrO4不可能转化为AgCl |
在2mlNaCl溶液中加入1滴AgNO3溶液,有白色沉淀生成;再加入1滴KI溶液沉淀转化为黄色,然后再加入1滴Na2S溶液,沉淀又转化为黑色(以上所用的溶液物质的量浓度均相同),下列表示各沉淀物溶解度由大到小的顺序正确的是
| A.Ag2S AgI AgCl | B.AgCl AgI Ag2S |
| C.AgI AgCl Ag2S | D.AgCl Ag2S AgI |
水是最常用的溶剂,许多化学反应都需要在水溶液中进行。请仔细分析并回答下列各题。
(1)用0.1mol/LNaOH溶液滴定体积均为20.00mL、浓度均为0.1mol/L盐酸和醋酸溶液,得到如下所示滴定曲线图: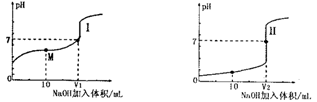
①用NaOH 溶液滴定醋酸溶液通常所选择的指示剂为________,符合其滴定曲线的是_______(填“I”或“II”);
②滴定前的上述三种溶液中,由水电离出的c(H+)最大的是_________溶液(填化学式);
③图中v1和v2大小的比较:v1_______v2 (填“>”、“<”或“=”);
④图I中M 点对应的溶液中,各离子的浓度由大到小的顺序是______________。
(2)某同学为了研究难溶电解质的溶解平衡,设计了如下实验(相关数据测定温度及实验环境均为25 ℃ ):
| 操作步骤 |
现象 |
| 步骤1:向20mL0.05mol/LAgNO3溶液中加入20mL0.05mol/LKSCN溶液,充分反应后过滤 |
出现白色沉淀 |
| 步骤2:向滤液中加少量2mol/LFe(NO3)3溶液 |
溶液变红色 |
| 步骤3:向步骤2所得溶液中,加入少量3mol/LAgNO3溶液 |
现象a |
| 步骤4:取步骤1所得少量滤渣加入到适量的3mol/LKI溶液中 |
出现黄色沉淀 |
查阅资料:AgSCN是白色沉淀:Ksp(AgSCN)=1.0×10-12;Ksp(AgI)=8.5×10-17.
① 请结合化学用语和必要的文字解释步骤2 现象出现的原因:____________________。
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为______________(任写一点即可)。
③ 写出步骤4 中沉淀转化反应平衡常数的表达式:K=__________。
25℃时,水的电离达到平衡:H2O H+ + OH-,下列叙述正确的是
H+ + OH-,下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| C.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| D.将水加热,Kw增大,pH不变 |
下列关于甲、乙、丙、丁四个图像的说法中,正确的是

| A.图甲表示向盐酸溶液中通入NH3过程中溶液导电性的变化 |
| B.由图乙可知,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO至pH在4左右 |
| C.图丙表示25 ℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1氨水,溶液的pH随加入盐酸体积的变化 |
| D.图丁表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化 |
向饱和食盐水中滴加一定浓度的盐酸,对出现现象的预测可能正确的是
| A.白色沉淀 | B.液体分层 | C.无明显现象 | D.黄绿色气体 |
溴酸银(AgBrO3)的溶解度随温度变化曲线如右上图所示,下列说法正确的是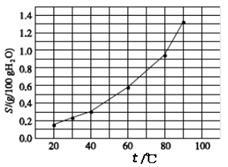
| A.温度升高不利于溴酸银的溶解 |
| B.溴酸银的溶解是放热过程 |
| C.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 |
| D.60 ℃时,将0.04g溴酸银加入到10g水中,形成的分散系中存在沉淀溶解平衡 |
试题篮
()