工业生产中常用MnS作为沉淀剂除去工业废水中Cu2+:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq),下列说法错误的是
| A.该反应达平衡时c(Mn2+)=c(Cu2+) |
| B.MnS的Ksp比CuS的Ksp大 |
| C.往平衡体系中加人少量CuSO4固体后,c(Mn2+)变大 |
D.该反应的平衡常数K=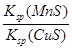 |
已知Ksp(BaSO4 )= 1.1×10-10,Ksp(BaCO3)=2.5×10-9。下列说法中不正确的是
| A.BaSO4比BaCO3溶解度小,所以,BaCO3可以转化为BaSO4 |
| B.BaCO3、BaSO4均不溶于水,所以都可以做钡餐试剂 |
| C.向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,c(SO42—)/ c(CO32—) =4.4×10-2 |
| D.常温下,BaCO3若要在Na2SO4溶液中开始转化为BaSO4,则Na2SO4的浓度必须不低于 2.2×10-6 mol·L-1 |
下列关于难溶电解质溶液说法正确的是 ( )
| A.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 |
| B.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度:①>④=②>③ |
| C.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-=Ag2S↓+2Cl- |
| D.25 ℃时,在Mg(OH)2悬浊液中加入少量的NH4Cl固体后,c(Mg2+)增大 |
一定温度下,向含有AgCl(s)的饱和AgCl溶液中加水,下列叙述正确的是( )
| A.AgCl的溶解度增大 | B.AgCl的溶解度增大,Ksp不变 |
| C.C(Ag+)增大 | D.AgCl的溶解度、Ksp均不变 |
已知t℃时,Ksp[Al(OH)3]=l×l0-33,Ksp[Mg(OH)2]=4×10-12。在含有0.20 mol/L H+且c(Mg2+)=c(A13+)=0.10mol/L的溶液中不断加入KOH溶液,沉淀的质量m(沉淀)与加入KOH溶液的体积V[KOH(aq)]关系的示意图正确的是( )
有关CaCO3的溶解平衡的说法中,不正确的是
| A.CaCO3沉淀析出和沉淀溶解不断进行,但速率相等 |
| B.CaCO3难溶于水,其饱和溶液几乎不导电,属于弱电解质溶液 |
| C.升高温度,CaCO3沉淀的溶解度增大 |
| D.向CaCO3沉淀中加入纯碱固体,CaCO3的溶解量降低 |
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
| A.加入Na2SO4可使溶液由a点变到b点 |
| B.通过蒸发可以使溶液由d点变到c点 |
| C.d点无BaSO4沉淀生成 |
| D.a点对应的Ksp大于c点对应的Ksp |
已知同温度下溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是
| A.Mg2++2HCO3-+2Ca2++4OH- = Mg(OH)2↓+2CaCO3↓+2H2O |
| B.Cu2++H2S = CuS↓+2H+ |
| C.Zn2++S2-+2H2O = Zn(OH)2↓+H2S↑ |
| D.FeS+2H+ = Fe2++H2 S↑ |
下列说法正确的是
| A.原电池工作,阴离子移向正极 |
| B.铁片表面镀锌,铁片接电源负极 |
| C.用Cu作电极电解H2O,阳极反应为:4OH-- 4e-=2H2O+O2↑ |
| D.向AgCl饱和溶液中加入NaCl固体, c(Cl-)增大,Ksp增大 |
下列说法中,正确的是( )
| A.粗铜精炼时,阳极产生0.5molCu2+则阴极有NA个Cu原子析出 |
| B.因为酸性H2SO3>H2CO3,所以S得电子能力大于C |
| C.可通过比较Mg(OH)2和MgCO3的Ksp的大小 比较它们的溶解性 |
| D.含0.1molNaClO的溶液蒸干可得5.85gNaCl固体 |
已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36。常温时下列有关说法正确的是
| A.除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
| B.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强 |
| C.因为H2SO4是强酸,所以反应:CuSO4十H2S=CuS↓+H2SO4不能发生 |
| D.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35mol/L |
把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq)。向悬浊液中加少量生石灰,若温度保持不变 ,下列判断正确的是 ( )
Ca2+(aq)+2OH-(aq)。向悬浊液中加少量生石灰,若温度保持不变 ,下列判断正确的是 ( )
| A.溶液中Ca2+ 数目增多 | B.溶液中c(Ca2+)增大 |
| C.溶液pH值不变 | D.溶液pH值增大 |
如表为有关化合物的pKsp,pKsp=-lgKsp。某同学设计实验如下:①向AgNO3溶液中加入适量NaX溶液,得到沉淀AgX;②向①中加NaY,则沉淀转化为AgY;③向②中加入NaZ,沉淀又转化为AgZ。则表中a、b、c的大小关系为( )
| 相关化合物 |
AgX |
AgY |
AgZ |
| pKsp |
a |
b |
c |
A.a>b>c B.a<b<c C.c<a<b D.a+b=c
将2×10- 5mol/LKCl 与2×10- 5mol/LAgNO3溶液等体积混合,下列说法正确的是 (已知AgCl 的Ksp=1.8×10-10 )
| A.有AgCl沉淀析出 | B.无AgCl沉淀析出 |
| C.无法确定有无AgCl沉淀析出 | D.有沉淀但不是AgCl |
试题篮
()