硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)某研究小组设计了制备Na2S2O3·5H2O的装置和部分操作步骤如下。
I.打开Kl,并闭K2,向圆底烧瓶中加人足量浓硫酸,加热。
II.C中的混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH接近7时即停止C中的反应。
III.过滤C中的混合液。
IV.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。
①I中,圆底烧瓶中发生反应的化学方程式是:_______________。
②II中“停止C中的反应”的操作是_______________。
③IV中将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。Na2S2O3·5H2O的溶解度随温度升高显著增大,所得产品通过___________方法提纯。
④装置B的作用是_______________。
(2)依据反应2S2O32-+I2=S4O62-+2I-,可用I2的标准溶液测定产品的纯度。取5.5g产品,配制成100mL溶液。取10mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol·L-1I2的标准溶液进行滴定,相关数据记录如下表所示。
| 编号 |
1 |
2 |
3 |
4 |
| 溶液的体积/mL |
10.00 |
10.00 |
10.00 |
10.00 |
| 消耗I2标准溶液的体积/mL |
19.99 |
19.98 |
17.13 |
20.03 |
①判断达到滴定终点的现象是________________。
②Na2S2O3·5H2O在产品中的质量分数是________(Na2S2O3·5H2O的式量为248,计算结果保留1位小数)。
(10分)掌握仪器的名称,组装及使用方法是中学化学实验的基础,如图为两套实验装置。

(1)写出下列仪器的名称:
① ② ④ ;
(2)仪器①~④中,使用时必须检查是否漏水的是:(填序号) 。
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器有 ,将仪器补充完整后进行的实验操作的名称为 ;该实验操作过程中需要通入冷却水,通入的方向是 (g或f)口进水, (g或f)口出水。
(4)现需配制250 ml 0.2 mol/L NaCl溶液,装置II是某同学转移溶液的示意图,图中的错误是 。

下图是实验室制取某些常见气体所使用的一些装置和仪器。

(1)写出实验室制取氧气的一个反应原理 ,用该方法制取氧气的发生装置是 ,收集装置可选择 。
(2)实验室制取二氧化碳,应选择的发生装置是 ,收集装置是 。欲收集满一瓶二氧化碳气体,需要用燃着的小木条放在集气瓶口,若观察到火焰熄灭,则接下来应进行的操作是 。若火焰不熄灭,则说明二氧化碳还没有收集满,应该继续收集。
(3)F装置的用途很广,下列关于该装置的用法正确的是 (将正确答案的序号填在横线上)。
| A.当装置内盛满水,若收集氢气,气体从b通入,若收集氧气,气体从a通入。 |
| B.当装置内盛有一半的浓硫酸时,除去氢气中的水蒸气,气体从b通入 |
| C.当装置内盛满氧气时,将装置内的氧气排除来,水从a通入 |
| D.当装置内盛有一半的水时,观察给病人输氧气的速率,a端连接氧气钢瓶,b端连接病人 |
苯和液溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。填写下列空白: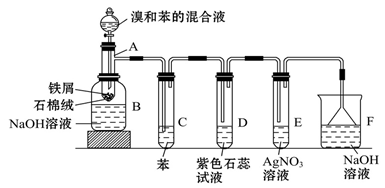
(1)试管C中苯的作用是:_____________________________________。
反应开始后,观察D和E两试管,看到的现象为: D ______________; E__________________________。
(2)反应2~3 min后,在B中的NaOH溶液里可观察到的现象是________________________________。
(3)在上述整套装置中,具有防倒吸的仪器有______________________________(填字母)。
乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成。乙醇和汽油经加工处理形成的车用燃料即乙醇汽油。结合有关知识,回答下列问题:
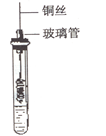
(1)在试管里加入2mL乙醇。把一端弯成螺旋状的铜丝放在酒精外焰中加热,使铜丝表面生成一薄层黑色的氧化铜,立即把它插入盛有乙醇的试管里(如图),取出铜丝,可以观察到铜丝表面 。
(2)写出乙醇与氧气催化氧化的化学反应方程式 。
(3)乙醇汽油作为一种新型车用燃料,符合我国的能源战略,推广使用乙醇汽油的好处是(写出一条即可) 。
为了检验淀粉水解的产物,设计如下实验方案:

请回答下列问题:
(1)试剂1为20%的H2SO4溶液,其作用是 。
(2)试剂2为 ,其作用是 ,使检验水解产物
的实验得以顺利进行;发生反应的离子方程式为 。
(3)反应①的化学方程式为 。
(4)为检验淀粉液是否已完全水解,取少量水解液于试管中,加入碘水,则证明淀粉未完全水解的现象是 。
(5)如果实验过程中没有加入试剂2而直接加入试剂3,能否实现实验目的 (填”能”或”否”),若不能,其原因是 ,最简单的改正措施是 。
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
已知:

| |
密度(g/cm3) |
熔点(℃) |
沸点(℃) |
溶解性 |
| 环己醇 |
0.96 |
25 |
161 |
能溶于水 |
| 环己烯 |
0.81 |
-103 |
83 |
难溶于水 |
(1)制备粗品:将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是 ,导管B除了导气外还具有的作用是 。
②试管C置于冰水浴中的目的是 。
(2)制备精品:
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在 层(填上或下),分液后,用 (填编号)洗涤环己烯。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从 (填f或g)口进入。蒸馏时要加入生石灰,目的是 。

③收集产品时,控制的温度应在 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是 。
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,最好的是 。
A.酸性KMnO4溶液 B.用金属钠 C.测定沸点
按要求填空:
(1)原子种类由 决定;第三周期半径最小的元素形成的简单离子的离子结构示意图是 ;
(2)以黄铁矿为原料生产硫酸的工艺流程如下图所示,设备B的名称为 ;设备A中发生反应的化学方程式 ;

(3)如下图是实验室中常用于测定盐酸和氢氧化钠溶液反应热的装置,此装置名称叫 ;


(4)0.5 mol CH3OH(l)完全燃烧生成二氧化碳气体和液态水时放出热量为363.2 kJ,写出表示CH3OH(l)燃烧热的热化学方程式 。
以下为五种有机物的有关信息,根据表中信息回答问题。
| A |
B |
D |
E |
F |
| ①由C、H、O 三种元素组成的液体; ②与水任意比例互溶。 |
其产量用来衡量一个国家的石油化工水平。 |
比例模型为: |
①可用于除水垢 ②在低于16.6℃时,凝固成冰一样的晶体。 |
由5个原子组成的10个电子的共价分子。 |
(1)A的官能团名称为________,对A的描述正确的是_________。
①有毒
②无色无味
③密度比水小
④与酸性高锰酸钾溶液反应使其褪色
⑤在海带提碘实验中作萃取剂从碘水中提取碘单质
⑥在热Cu丝作用下生成相对分子质量比它小2的有机物
A.①③⑤ B.②③④ C.③④⑥ D.④⑤⑥
(2)B的电子式为 ,把一定体积的B、F混合气体通过溴水,有
反应(填反应类型)发生,当溴水的质量增加2.8g时,生成物的质量为 g。(能用到的相对原子质量:H 1;C 12;O 16;Br 80)
(3)工业上,D来源于煤 (填操作名称)后的液态产物煤焦油。D在浓硫酸、
50~60℃水浴中与浓硝酸发生取代反应,生成的有机物的结构简式为 。
(4)写出用18O标记的A与不含18O的E在一定条件下发生反应的化学方程式(注明反应条件)。 。
下图为实验室进行该反应时的装置图,其中有 处错误。

利用下图所示实验(部分装置)收集氯气并验证氯气的性质:
(1)A为Cl2的发生装置。若制取氯气的化学方程式为________________,与之对应的A装置是__________(填写装置的序号)。
(2)利用D中的广口瓶收集氯气,试在装置图中完善D装置(将虚线表示的一根或两根导管改为实线,也可都不改)。
(3)写出装置E中反应的离子方程式________________。
(4)利用D中收集的氯气进行铁与氯气的反应实验:用坩埚钳夹持一束细铁丝, ______________,然后伸入盛有氯气的集气瓶中。
(5)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-,反应的离子方程式为__________。试设计实验方案,检验洗气瓶B溶液中Cl 和SO
和SO 的存在。可供选择的试剂及仪器为:稀盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液、AgNO3溶液、澄清石灰水、试管、胶头滴管。
的存在。可供选择的试剂及仪器为:稀盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液、AgNO3溶液、澄清石灰水、试管、胶头滴管。
海水中化学资源的利用具有非常广阔的前景。
(1)目前世界上60%的镁是从海水中提取的,其主要步骤如下:

①试剂Ⅰ适宜选用 (填序号)。
A.盐酸 B.石灰乳 C.氯化钠溶液
②操作Ⅰ的名称是 。
③工业上通过电解熔融的MgCl2制备金属Mg,该反应的化学方程式是 。
(2)下图是某课外小组在实验室模拟从海水中提取溴的实验装置。

A装置中通入Cl2一段时间后,改通热空气,将Br2吹出至B装置。
①A装置中发生反应生成Br2的离子方程式为 。
②B装置中,Br2被SO2还原,B装置中产生的两种主要阴离子的符号为 、 。
③C装置中NaOH溶液的作用是 。
能源是现代社会发展的支柱之一。
(1)化学反应中的能量变化,通常主要表现为热量的变化。
①下列反应中,属于放热反应的是___________(填序号)。
a. Ba(OH)2·8H2O与NH4Cl混合搅拌
b. 高温煅烧石灰石
c. 铝与盐酸反应
②某同学进行如下图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化。实验表明:反应温度升高,由此判断该反应是_______(填“吸热”或“放热”)反应,其离子方程式是_______________。
(2)电能是现代社会应用最广泛的能源之一。
下图所示的原电池装置中,其负极是_____________________,正极上能够观察到的现象是___________________,正极的电极反应式是______________________。
原电池工作一段时间后,若消耗锌6.5g,则放出气体__________g。
葡萄可用于酿酒。
(1)检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是_______________________________________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式
C6H12O6(葡萄糖) 2________+2C2H5OH
2________+2C2H5OH
(3)葡萄酒密封储存过程中生成了有香味的酯,酯也可以通过化学实验来制备。实验室用下图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是________________________________。
②试管b中盛放的试剂是饱和_________________溶液。
⑧实验开始时,试管b中的导管不伸入液面下的原因是___________________。
④若分离出试管b中生成的乙酸乙酯,需要用到的仪器是____(填序号)。
a. 漏斗 b. 分液漏斗 c. 长颈漏斗
实验室用溴和苯在FeBr3催化下制取溴苯,得到粗溴苯后,要用如下操作提纯:(1)蒸馏;(2)水洗;(3)用干燥剂干燥;(4)用10%的NaOH溶液洗涤。正确的操作顺序是
| A.(1)(2)(3)(4) | B.(4)(2)(3)(1) |
| C.(4)(1)(2)(3) | D.(2)(4)(2)(3)(1) |
试题篮
()