(9分)实验中学进行化学实验操作考试,准备了三个考题:①氧气的制取、收集和验满 ②分子是不断运动的探究 ③过滤。
小华同学抽签后被监考老师引导至准备了下列仪器和药品的实验台前:请回答:
①指出上图中仪器a的名称: ;
②由实验台上提供的仪器和药品,你认为小华抽到的是第 个考题;
③以下是小华完成该实验主要操作过程的示意图。
在操作Ⅱ中发生反应的化学方程式是 ;按评分标准,每项操作正确得1分,满分5分,你认为实验完毕后小华得了 分;请挑一个失分操作,并写出正确的操作方法 。
(2)小凯同学抽到了与小华相同的考题,实验台上只提供了一种固体粉末状药品和一些仪器。
①写出小凯同学制取氧气的化学方程式 ;
②与小华同学所用的仪器相比,小凯同学完成实验至少还需要 ;(填一种仪器名称,导管可以更换)。
下列A ~ F是初中化学中的六个实验装置,请按要求填空:



A、洗气瓶 


(1)医院可用A装置来观察给病人输氧情况,导管 ▲ (填“a”或“b”) 应连接病人吸氧气的塑胶管。
|
请你参与实验室配制一定溶质质量分数的硝酸钾溶液的实验,并进行实验过程的探究:
(1)计算:配制50g质量分数为10%的硝酸钾溶液,所需硝酸钾质量为 g,所需蒸馏水的体积为 mL(水的密度约为1g/mL)。
(2)称量:分别在天平左右两盘放上纸片,调节平衡后,应 (填标号)。
A.先在托盘上放置所需的砝码,再添加硝酸钾直至天平平衡。
B.先添加所需的硝酸钾,再添加砝码到所在的托盘直至天平平衡。
【探究一】在称量过程中,某同学的称量操作如图所示,你认为该操作对本次实验的数据处理的正确性 (填“有”或“没有”)影响,理由是 .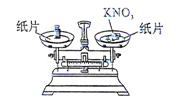
(3)量取:准确量取所需蒸馏水要用到的仪器是 (选填图中的标号)。
(4)溶解:将称量好的硝酸钾和蒸馏水混合溶解。
【探究二】:20℃时,将20mL质量分数为10%的硝酸钾溶液,稀释成质量分数为4%的硝酸钾溶液.从表中找出计算所需的数据为: g/mL.
| 温度℃ 质量分数% |
20 |
40 |
60 |
| 4 |
1.023 |
1.016 |
1.007 |
| 10 |
1.063 |
1.054 |
1.044 |
下列图( I )是部分常用化学仪器或装置,图(Ⅱ)是部分“微型”化学仪器或装置(用“微型”仪器做实验,其试剂用量和废物排放量是通常用量的l/10或更少,符合绿色化学的理念)。对比图(I)和图(Ⅱ)回答以下问题:
⑴图( I )中A、B的名称分别是 、 ;
⑵用图(Ⅱ)中的“微型”仪器做实验,固体只需极少量、液体用量也很少(或只需1~2小滴),相对用图(I)仪器做实验的优点是 、 、 (填序号):
①节约药品用量 ②能完全消除实验污染 ③方便个人或家庭实验 ④若需加热也能节约燃料
⑶图( I )中的C装置的作用相当于图(II)中的装置 (填字母),它们在实验操作上的共同优点是通过控制 来控制反应速度。
通过海水晾晒可得粗盐。粗盐除NaCl外,还含有MgCl2、CaCl2以及泥沙等杂质。为了有效将粗盐提纯,实验的各步操作流程如下图所示。
[ MgCl2+2NaOH=Mg(OH)2↓+2NaCl CaCl2+Na2CO3=CaCO3↓+2NaCl ]
根据以上信息回答:
(1)在完成操作之前,必须加入的X物质是 。
(2)操作Ⅰ和操作Ⅱ的名称是 。该操作中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是 (填序号)。 
A B C D
(3)在蒸发操作中容易造成食盐固体飞溅,为尽量减少飞溅,可采取用 等措施。
A玻璃棒不断搅拌 B 来回移动酒精灯加热 C 来回移动蒸发皿加热
(4)在实验过程中加入过量的NaOH溶液,其实验目的是 。(5)判断加入的盐酸“适量”的方法是 。
(6)实验所得精盐的质量大于粗盐中NaCl的质量,原因是 。
(6分)根据下图回答问题: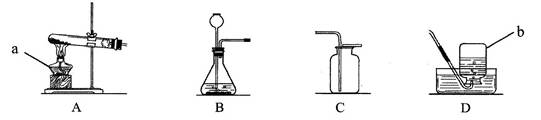
(1)写出图中标号仪器名称:a , b 。
(2)实验室用高锰酸钾制氧气可选用的发生装置是 ,反应的化学方程式为 。检查装置气密性时,除了用手紧握的方法外,还可以采用的方法是
我市初三学生5月18日进行理化实验操作考核,其中一项是“配制50g 6%的氯化钠溶液”。该实验的部分操作如下图所示。 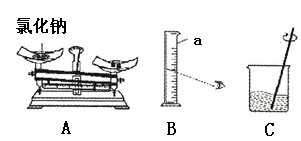

(1)需要称取氯化钠的质量是________________g,称量时A出现了右盘低的现象,接下来的操作应该是____________________。
①左边的平衡螺母向左调 ②右边的平衡螺母向右调
③右盘中减少砝码 ④左盘中增加食盐
(2)B中仪器a的名称是__________________。量取水时,如果按照图B的方法读数,会使配制的溶液溶质质量分数_______________(填“偏大”或“偏小”)
(3)C中用玻璃棒搅拌的作用是________________________。
(4)D中所贴标签有不妥之处,并在方框中 写出你认为适合的内容。
写出你认为适合的内容。
某工厂综合加工海水的主要步骤如图所示.
请根据图示回答下列问题:
(1)操作I的名称是_______________。
(2)试剂1是___________________(写化学式,下同),白色沉淀D是____________。
(3)溶液B中含有的溶质是__________________________。向溶液B加入试剂2后,在溶液中可观察到_______________________________的现象。
(4)在熔融状态下电解无水氯化镁会产生一种金属单质和一种双原子分子的气体单质,该反应的化学方程式是__________________________________________________。
铜跟浓硫酸的反应原理是: ↑。某小组同学用下图所示装置制取硫酸铜。请回答以下问题:

(1)图中
装置用来收集
(已知
的密度大于
的密度),但未将导管画全,请在答题纸上将
装置中的导管补画完整。
(2)图中
装置的作用是防止氢氧化钠溶液倒吸入
瓶中,装置
的作用是.
(3)充分反应后,烧瓶中的铜片仍有剩余,那么硫酸是否也有剩余呢?该小组同学进一步研究:待烧瓶冷却后,将烧瓶中的混合物稀释、过滤,用滤液做了如下实验。
实验1:用
试纸测试滤液
,其
约为1;
实验2:取少量滤液于试管中,向试管中滴加氯化钡溶液,有白色沉淀现象。
你认为,可说明硫酸有剩余。(选填"实验1"或"实验2")
(4)以铜片与浓硫酸为原料用上述方法制取硫酸铜,存在的缺陷有(答出两点即可。)
氯化钠是生活必需品,也是重要的化工原料。提纯含少量泥沙的粗盐,一般经过以下操作流程: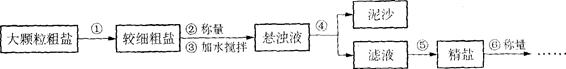
(1)操作①中必须用到的一种仪器是 (填序号)。
A.研钵 B.量筒 C.烧杯 D.试管
(2)操作④中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是 (填序号)
(3)操作⑤中除用到三脚架、洒精灯、玻璃棒、坩埚钳外,还需要用到 等仪器。该操作中容易造成食盐固体飞溅,为尽量减少飞溅,除连续搅拌外还可采取 等措施。
(4)实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低、其可能原因是
(填序号).
A.食盐没有全部溶解即过滤
B.蒸发时食盐飞溅剧烈
C.蒸发后,所得精盐很潮湿
D.器皿上沾有的精盐没全部转移到称量纸上
(1)已知:水的密度为1.0g/mL。实验室配制50g溶质质量分数为5%的氯化钠溶液,需要称取氯化钠2.5g,需要量取水。
(2)配制的操作示意图如下,该实验的正确操作顺序为(填字母序号)。

(3)经检测,所配制溶液的溶质质量分数偏小,其原因可能是(填序号)。
①氯化钠固体不纯
②称量时,砝码端忘垫质量相同的纸片
③量取水时,仰视读数
④装瓶时,有少量溶液洒出
下图是实验室中用于制取气体、验证性质的装置图,请回答下列问题:
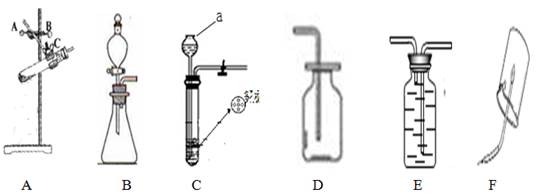
(1)图C仪器a名称
(2)若选用A装置加热氯酸钾和二氧化锰的混合物制取氧气,化学方程式: ,所缺仪器是的名称 ,需调节该装置旋钮 ,使 。
(3)若用D装置收集二氧化碳,验满的方法是 。
(4)先用 E 装置收集氢气,则气体从 进(填“长管”或“短管”),然后验证其性质,如图F,观察到火焰的颜色为 。
(5)某同学用二氧化锰粉末和过氧化氢溶液制取氧气,化学方程式为: 。若用A装置,发现反应过于剧烈,不易控制,此时可以选择 装置获得平稳的氧气流。若用所选装置与装置E连接,加入13.6g一定质量分数的过氧化氢溶液制取氧气,理论上应收集2.2L氧气,而实际收集到氧气的体积约为3.2L,这是因为 。
试题篮
()