下表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
| 溶解度/g |
Ca(OH)2 |
0.19 |
0.17 |
0.14 |
0.12 |
0.09 |
0.08 |
| NaOH |
31 |
91 |
111 |
129 |
313 |
336 |
(1)依据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,下图中能表示NaOH溶解度曲线的是 (填A或B)。
(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:
①加入氢氧化钙,②升高温度,③降低温度,④加入水,⑤蒸发水后再恢复到原温度,⑥加入生石灰。
其中措施正确的是 。
A.②④⑥ B.③④ C.①③⑤⑥ D.①②⑤⑥
(3)20℃时,191g 饱和NaOH溶液,蒸发10g水后,再降温到20℃,可析出NaOH晶体的质量为 。
(4)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液中溶质的质量分数乙 甲(填“>”、“<”或“=”)。
(5)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是 。
(6)20℃时,欲测定NaOH溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则所测溶液的
pH (填“偏大”、“偏小”或“不受影响”)。
下图是“侯氏制碱法”在实验室进行模拟实验的生产流程示意图,根据所学知识回答后面的问题:
(1)将气体A通入紫色石蕊试液,石蕊试液变蓝色,气体A是 (填化学式),
(2)步骤③需要进行的操作是 (填写“过滤”、“加热”之一)
(3)步骤②中发生反应的原理是NaCl+NH3+CO2+H2O =NaHCO3↓+NH4Cl,过程中能析出碳酸氢钠晶体的原因
是 (选填字母)
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解 c.碳酸氢钠的溶解度相对较小
(4)如图是氯化铵和氯化钠两种固体物质的溶解度曲线
①温度为t2℃时,20g NaCl溶解到50g水中,得到的溶液的质量为 g
②温度为t1℃时,NH4Cl饱和溶液中溶质的质量分数 (填“大于”、“等于”或“小于”)NaCl饱和溶液中溶质的质量分数。
③将温度为t1℃的NH4Cl饱和溶液升温至t2℃,所得溶液为t2℃时的 (填“饱和溶液”或“不饱和溶液”)此时溶液溶质质量分数会 (填“增大”或“减小”或“不变”)。
④若某温度时NH4Cl的饱和溶液中溶解有少量的NaCl,若用实验方法得到大量的NH4Cl晶体,所采用的方法是 。
⑤向氯化铵与氯化钠的混合溶液中滴加少量的硝酸银溶液,请写出反应的一个化学方程式: 。
遂宁境内的卓筒井是手工制盐的活化石,被誉为“中国古代第五大发明”、“世界石油钻井之父”,不仅是古代劳动人民勤劳、智慧的象征,也造福了千秋万代。其工艺流程包括下面五个步骤:
请结合所学化学知识,回答下列问题:
(1)第②步汲出的卤水浑浊,浓度一般在7~10度(即溶质质量分数为7%~10%,下同),这样的卤水咸度低,耗燃料,成本高,为了把卤水浓度提高18~20度,就产生了“晒卤”这一环节。在“晒卤”的过程中溶液溶质质量分数 (填“不变”、“变大”或“变小”)。
(2)第④步“滤卤”和实验室“过滤”的原理一样,都是为了除去液体中的不溶性杂质。在实验室的过滤操作中,必须用到的玻璃仪器有:烧杯、玻璃棒、 ,其中玻璃棒的作用是 。
(3)第⑤步“煎盐”和实验室 结晶(填结晶的方法)的原理相同。
(4)如图是甲、乙、丙三种物质的溶解度曲线图,
据图回答下列问题:
Ⅰ.甲、乙两种物质在 ℃时溶解度相同。
Ⅱ.t2℃时,甲、乙、丙三种物质溶解度由大到小排列为 。
Ⅲ.t4℃时,将三种物质各ag分别加入100g水中,充分溶解后,只有一种能形成饱和溶液,则a的取值范围是 。
下图为硝酸钾和氯化钠的溶解度曲线。由图可知:
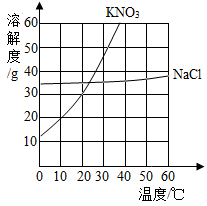
(1)当温度为30℃时,硝酸钾的溶解度 (填“>”、“<”或“=”)氯化钠的溶解度。
(2)当硝酸钾中含有少量氯化钠时,可用 法提纯硝酸钾。
(3)硝酸钾、氯化钠都属于 (填“易溶”、“可溶”、“微溶”或“难溶”)物质。
(4)10℃时,将12g硝酸钾加入50g水中不断搅拌,形成溶液是 (填“饱和”或“不饱和”)溶液,溶液质量为 。
如图表示甲、乙两种物质的溶解度曲线图,下列有关说法错误的是
| A.t3℃时,甲的溶解度大于乙的溶解度 |
| B.要使接近饱和的甲溶液转化为饱和溶液可以采取降低温度的方法 |
| C.t2℃时,甲、乙两物质的溶液中溶质的质量相等 |
| D.将t3℃时等质量的甲、乙饱和溶液降温到t2℃,所得溶液中溶质的质量分数相等 |
如图所示是A、B、C三种物质的溶解度曲线,
据此图回答:
(1)t1℃时,A、B、C三种物质的溶解度由大到小的顺序是
(2)t2℃时,将30gA放入100g水中,充分搅拌后,所得溶液的溶质质量分数是
(3)t3℃时,将等质量A、B两种物质的饱和溶液降温到t2℃时,析出晶体质量较大的是 。
(4)t3℃时,将25gC放入100g水中,充分搅拌后得到C的饱和溶液,在不改变溶剂量的前提下,将其变为不饱和溶液的方法是 。
甲、乙、丙三种固体物质的溶解度曲线如图所示,
请回答:
(1)25℃时,将25g甲固体加入到50g水中,充分溶解并恢复到原温度后,得 到溶液的质量为 g。
(2)若甲固体中含有少量乙,则提纯甲的方法是 (填“蒸发结晶、降温结晶”之一)。
(3)将25℃时乙的饱和溶液升温到35℃,则其溶液的溶质质量分数 (填“变大”、“变小”或“不变”)。
(4)35℃时,分别用等质量的甲、乙、丙配制该温度下的饱和溶液,所得溶液的质量最小的是 。
(5)如图所示,35℃时,A、B两试管中分别盛有甲、丙的饱和溶液,并都有少量固体存在。若向试管外盛有水的烧杯中加入某固体物质后,A试管内固体明显减少,B试管内固体逐渐增多。
则加入的物质可能是 (写出一种物质的化学式)。
(13分)生活处处皆化学。
(1)金属在生活中用途广泛
①下列生活用品,主要是由金属材料制成的是 ;
②用铁锅烹饪食物时,会增加食物中的铁元素。请你写出一个厨房中防止铁锅生锈的方法 。
(2)生活中的水和溶液
①二氧化氯是一种新型的消毒剂,二氧化氯中氯元素的化合价为 ;
②欲配制500mL 0.9%的生理盐水(密度为1.0 g/mL),需要NaCl的质量为 g;配制过程中,玻璃棒的作用是 。
经检测,所配生理盐水的溶质质量分数偏小,其原因可能有 (填序号);
A.氯化钠固体不纯
B.称量时砝码端忘垫质量相同的纸片
C.量取水时,俯视读数
D.装瓶时,有少量溶液洒出
③下图是净化河水的简易装置,下列说法正确的是 ;
A.净化后的水是纯净物 B.此装置能对水杀菌消毒
C.此装置能把硬水变为软水 D.活性炭能吸附水中的色素及异味
④KNO3可用作配制无土栽培营养液,下表提供了KNO3在不同温度时的溶解度:
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
| 溶解度/g |
13.3 |
31.6 |
63.9 |
110 |
169 |
a.20℃时,将10gKNO3加入50g水中充分溶解,所得溶液的质量为 g,
b.现有60℃时的KNO3饱和溶液210 g,降温至20℃,会析出KNO3 g,
c.某同学用10%的KNO3溶液作营养液,则该营养液中氧元素的质量分数为 。
下图为A、B两种固体物质的溶解度曲线。请根据图示回答: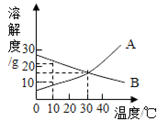
(1)A物质的溶解度随温度的升高而______________(填“增大”、“不变”或“减小”)。
(2)10℃时,A、B的溶解度大小关系是A_____________B(填“大于”、“等于”或“小于”)。
(3)将30℃的A、B两种接近饱和的溶液通过升高温度可达到饱和的是_________溶液。
(4)若将10℃的A、B两种饱和溶液的温度升高到30℃,此时两种溶液中溶质质量分数的大小关系是A_________B(填“大于”、“等于”或“小于”)。
下图为a、b两物质的溶解度曲线,据图回答:
(1)要从b物质的溶液中析出晶体,通常采用的方法是 。
(2)若要得到溶质质量分数为20%的a溶液,配制时的温度应不低于 ℃
根据下图两种物质的溶解度曲线,回答问题:
(1)升高温度,可使 的不饱和溶液变为饱和溶液。
(2)50℃时甲的饱和溶液中溶质的质量分数为 。(保留到小数点后一位)
(3) 时,甲、乙两种物质的溶解度相等。
(4)要使乙从其浓溶液中析出,可采用的方法是 。
(4分)A、B、C三种固体物质溶解度曲线如图所示。
请回答:
(1)图中M点的意义________________________________________,
(2)将某温度下的C的不饱和溶液转化为饱和溶液,采用的方法是____________________ (填一条即可),
(3)现有t1℃时A、B、C的三种饱和溶液,分别将它们升温到t3℃,溶质的质量分数最大的是____________________,
(4)甲、乙试管中分别装有t3℃的100g和200g的相同浓度的A的不饱和溶液,将两份溶液分别都恒温蒸发20g水,都析出了晶体。析出晶体的质量关系为甲__________乙(填“大于”或“等于”或“小于”)。
水和溶液在生产生活中重要的作用.
(1)自来水厂常用的净水方法有沉淀、_________吸附、消毒等;在日常生活中常用来降低水的硬度的方法是_________;水是一种宝贵的自然资源,我们必须爱护水资源.预防水污染的措施有_________(写一条即可).
(2)如图是甲、乙两种物质的溶解度曲线,回答下列问题:
①_________时,甲、乙两种物质的溶解度相等;
②若固体甲中含有少量乙时可用________方法提纯甲(填”蒸发结晶“或”冷却结晶“);
③t2℃用等质量的甲、乙两种物质配置甲、乙的饱和溶液需要水的质量甲_________乙(填“>”“<”或“=”);
④配置一定溶质质量分数的甲物质溶液,以下操作中会导致所配置溶液溶质质量分数偏低的是_________.
A.量筒量取水时仰视读数
B.配合的溶液向细口瓶转移时溅出
C.固体甲中含有杂质.
试题篮
()