如图1是A、B、C三种物质的溶解度曲线,请回答。
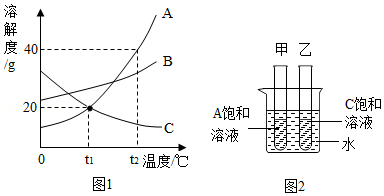
(1)t 2℃时,将30克A物质放入50克水中,充分溶解后所得溶液中溶质与溶剂的质量比为 。
(2)A物质中混有少量B物质,若提纯A物质,可采取的结晶方法是 。
(3)t 1℃时,取等质量的A、C饱和溶液分别置于甲、乙两支试管中,如图2所示。在大烧杯中加入一定质量的硝酸铵固体溶解后,A、C溶液的溶质质量分数的大小关系是 。
图为甲、乙两种固体物质在水中的溶解度曲线。下列说法错误的是
| A.甲物质的溶解度随温度的升高而增大 |
| B.在t1℃时,甲、乙两物质的溶解度相等 |
| C.在t2℃时,N点表示甲物质的不饱和溶液 |
| D.在t1℃时,甲物质的饱和溶液中溶质的质量分数是25% |
KNO3和KCl在不同温度时的溶解度如下表所示:
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
138 |
KCl |
27.6 |
31.0 |
34.0 |
37.0 |
40.0 |
42.6 |
45.5 |
48.3 |
回答下列问题:
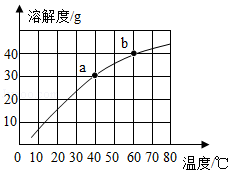
(1)20℃时,KCl的溶解度为 g。
(2)依据表中数据,绘制KNO3和KCl的溶解度曲线,如图中能表示KCl溶解度曲线的是 (选填“a”或“b”)。
(3)20℃时,向10g水中加入2.5g KNO3充分搅拌得到X,再加入2.5g KNO3充分搅拌得到Y,继续升温至50℃得到Z,则X、Y、Z中为饱和溶液的是 。
(4)40℃时,现有质量均为100g的硝酸钾和氯化钾两种饱和溶液,若将它们同时降温至10℃.下列说法正确的是 。
A.40℃时,硝酸钾饱和溶液中水的质量大于氯化钾饱和溶液中水的质量
B.降温至10℃时,析出的KNO3晶体质量比析出的KCl晶体质量大
C.降温至10℃时,硝酸钾饱和溶液的质量分数大于氯化钾饱和溶液的质量分数
D.当温度降至20℃和30℃之间的某一温度,两种溶液的质量分数可能相等

甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是( )

A.甲的溶解度大于乙的溶解度
B.t1℃时,甲、乙饱和溶液中溶质的质量分数相等
C.t2℃时,60g甲的饱和溶液稀释到20%需加水10g
D.将t1℃时相等质量的甲、乙的饱和溶液升温到t2℃,溶液中溶质的质量甲大于乙
南海是我国的固有领海,蕴藏着丰富的海洋资源。2017年5月18日,我国南海神狐海域的可燃冰试采取得圆满成功,实现历史性突破。
(1)可燃冰的主要成分是甲烷。请你写出甲烧在空气中燃烧的化学方程式: 。
(2)可燃冰被科学家誉为“未来能源”“21世纪能源”,原因是 。
(3)1926年,我国著名化学家侯德榜先生创立了侯氏制碱法,促进了世界制碱技术的发展。侯氏制碱法以食盐为主要原料制取纯碱,制得的纯碱中常含有少量氯化钠。Na2CO3和NaCl的溶解度曲线如图2所示,试回答下列问题:

①t1℃时,NaCl的溶解度 Na2CO3的溶解度(填写“大于”“等于”“小于”之一)。
②t1℃时,50g水中加入10g Na2CO3,经充分溶解,所得溶液中溶质与溶液的质量之比为 (填最简整数比)。
③t1℃时,将不同质量的碳酸钠饱和溶液和氯化钠饱和溶液均升温至t2℃,此时所得碳酸钠溶液溶质质量分数 氯化钠溶液溶质质量分数(填写“大于”“等于”“小于”“无法判断”之一)。
将20g KOH加入100g水中,配制成溶液。下列说法错误的是( )
| A. |
KOH在水中解离出K+和OH﹣ |
B. |
一个K+带一个单位正电荷 |
| C. |
该溶液的溶质质量分数为20% |
D. |
向该溶液中滴入酚酞指示剂,溶液变红 |
如图为甲、乙两种固体物质在水中的溶解度曲线.下列说法错误的是( )

| A.甲物质的溶解度随温度的升高而增大 |
| B.在t1℃时,甲、乙两物质的溶解度相等 |
| C.在t2℃时,N点表示甲物质的不饱和溶液 |
| D.在t1℃时,100g乙物质的饱和溶液中溶质的质量是25g |
水是一种重要的物质。
(1)用水可以获得氢气。请写出一个由水生成氢气的化学方程式 。
(2)水还可以用于鉴别物质。水鉴别氯化钠和硝酸铵依据的是 。
(3)水是最常见的溶剂。
①下列溶液用水作溶剂的是 (填字母序号);
A.生理盐水
B.碘酒
C.葡萄糖溶液
②将100g溶质质量分数为98%的浓硫酸稀释为溶质质量分数为10%的稀硫酸,需加水的质量为 g;
③如图为某物质在水中的溶解度曲线,欲使a点所示溶液变为b点,可采取的措施是 。
④20℃时,用精密仪器称量5.85g NaCl和7.90g NH4HCO3,放入盛有50.00g 水的烧杯中,充分搅拌,静置,有晶体析出。请结合下表分析,理论上析出的晶体及晶体的质量分别为 。
20℃时,五种物质在水中的溶解度
物质 |
NaCl |
NH4HCO3 |
NH4Cl |
NaHCO3 |
Na2CO3 |
溶解度/g |
36.0 |
21.0 |
37.2 |
9.6 |
21.5 |
下列说法中,不正确的是( )
A.溶液中有晶体析出时,溶质质量减小,则溶质质量分数一定减小
B.将钢铁制成合金是有效减缓钢铁制品锈蚀的方法之一
C.碱溶液中都含有氢氧根离子,因此碱具有相似的化学性质
D.自然界中二氧化碳的循环平衡,对地球生命具有重要意义
下图是
、
、
三种固体物质的溶解度曲线图,根据曲线图回答下列问题。

(1)如果要配制相同浓度的
、
饱和溶液,需要把温度控制在℃。
(2)t1℃时,将
、
、
的饱和溶液都升温到t3℃,溶液仍然饱和的是的溶液。
(3)t3℃时,将
、
、
的饱和溶液都降温到t1℃,溶液中溶质质量分数由小到大的顺序为。
根据下表回答问题:
温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
|
溶解度 /g |
NaCl |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
NH4Cl |
33.5 |
37.2 |
41.4 |
45.8 |
50.4 |
55.2 |
|
(1)海水中含有大量的氯化钠,海水晒盐的原理是 ,氨碱法制纯碱先向饱和食盐水中通入氨气,通入氨气的作用是 ,可向滤出晶体后的NaHCO3溶液中加入 以回收氨,使之循环使用。
(2)氯化钠和氯化铵具有相同溶解度的温度范围在 ℃之间。
(3)图中,A是60℃时含有120g水的NH4Cl溶液,经过如下操作后,得到固体。

I.C中溶液的质量是 g.A溶液为NH4Cl的 (选填“饱和”或“不饱和”)溶液,该溶液中溶质的质量分数为 (结果精确到0.1%)。
II.对以上过程的分析,正确的是 (选填编号)。
①A到B的过程中,溶质质量没有改变
②B中溶质与溶剂的质量比为55.2:100
③由B到C开始析出NH4Cl固体的温度在40℃至50℃之间。
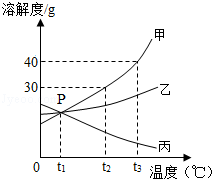
如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,回答下列问题。
(1)P点表示在温度为t1℃时,三种物质的溶解度 。
(2)t2℃时,在温度不变的情况下要将丙的不饱和溶液变成饱和溶液的方法是 (任写一种)。
(3)t2℃时,将25g甲固体加入到50g水中,充分溶解并恢复到原温度后,所得溶液的质量是 g。
(4)t3℃时,三种物质的溶解度由大到小的顺序为 。
(5)将t3℃时丙的饱和溶液降温到t2℃,溶液中溶质的质量分数 (填“变大”、“变小”或“不变”)。
根据下表回答问题:
温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
|
溶解度 /g |
NaCl |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
NH4Cl |
33.5 |
37.2 |
41.4 |
45.8 |
50.4 |
55.2 |
|
(1)海水中含有大量的氯化钠,海水晒盐的原理是 ,氨碱法制纯碱先向饱和食盐水中通入氨气,通入氨气的作用是 ,可向滤出晶体后的NaHCO3溶液中加入 以回收氨,使之循环使用。
(2)氯化钠和氯化铵具有相同溶解度的温度范围在 ℃之间。
(3)图中,A是60℃时含有120g水的NH4Cl溶液,经过如下操作后,得到固体。

I.C中溶液的质量是 g.A溶液为NH4Cl的 (选填“饱和”或“不饱和”)溶液,该溶液中溶质的质量分数为 (结果精确到0.1%)。
II.对以上过程的分析,正确的是 (选填编号)。
①A到B的过程中,溶质质量没有改变
②B中溶质与溶剂的质量比为55.2:100
③由B到C开始析出NH4Cl固体的温度在40℃至50℃之间。
四个图像分别对应四个变化过程,其中正确的是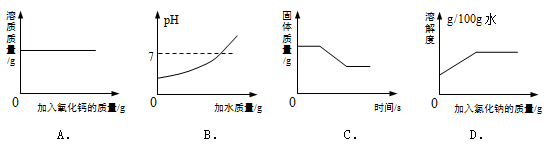
| A.一定量的饱和石灰水中加入氧化钙 |
B.向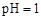 的溶液中加水 的溶液中加水 |
| C.高温煅烧一定质量的石灰石 |
| D.t℃时,在一定量的氯化钠不饱和溶液中不断加入氯化钠固体 |
在不同温度下溶解度的数据如下表:
| 温度℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
| 溶解度/ | 27.6 |
31.0 |
34.0 |
37.0 |
40.0 |
42.6 |
45.5 |
48.3 |
51.1 |
54.0 |
56.7 |
(1)60℃时,100
水中最多可溶解
。
(2)90℃时,100
饱和
溶液冷却到30℃时,溶液的质量(选填">"或"<"或"=")100
。
(3)40℃时,
饱和溶液中溶质质量分数为;该溶液升温到60℃时,溶液属于溶液(选填"饱和"或"不饱和")。
试题篮
()